Almacenamiento conforme a GxP de productos farmacéuticos: Con el sistema de monitorización ambiental completamente automatizado testo Saveris Pharma

Con el sistema de monitorización ambiental completamente automatizado testo Saveris Pharma
Todos los días, la logística farmacéutica se enfrenta a tres grandes desafíos: Los productos farmacéuticos que le han sido confiados deben estar disponibles en la cantidad correcta, con una calidad excelente y en el lugar indicado. Además, para los responsables también es imprescindible tener en cuenta los amplios reglamentos nacionales e inter- nacionales vigentes en todo el mundo para todo el sector farmacéutico con el fin de garantizar la calidad. Concreta- mente, esto significa que los valores ambientales definido y constantes no solo deben respetarse en la fabricación de los productos médicos sensibles a la temperatura, sino también en el almacenamiento, el transporte y la distribución.
El sistema de monitorización ambiental completamente automatizado testo Saveris Pharma asume por usted la supervisión fiable y segura, así como la documentación de la temperatura y la humedad durante el almacenamiento de mercancías farmacéuticas. La solución completa conforme a GxP consta de una tecnología de medición de alta precisión, un software intuitivo y validable, así como de servicios completos para la cualificación, validación y calibración.
Mediante este concepto integral, testo Saveris Pharma le brinda apoyo para cumplir siempre con los estrictos requisitos reglamentarios y no solo a cumplir con la conformidad GxP, sino a experimentarla.
Requisitos a la logística farmacéutica.
El almacenamiento, el transporte y la distribución de productos farmacéuticos a nivel global no se puede comparar con cualquier otro mercado logístico. La logística farmacéutica es versátil, está enlazada ampliamente y regulada de forma estricta, y una gran parte de los productos salva vidas. Por esta razón, las empresas involucradas requieren procedimientos homogéneos de procesamiento, equipamientos especiales para el transporte, condiciones de almacenamiento apropiadas y un grado elevado de conciencia referente a la conformidad para trabajar de forma exitosa, segura y conforme a las normativas. Solo así se garantiza la eficacia y la calidad de los productos farmacéuticos, así como la seguridad y la salud de los pacientes y los consumidores.

Un mercado en crecimiento en movimiento
El mercado global para la logística farmacéutica del año 2019 se ha valorado en 69 mil millones de dólares. Desde 2020 hasta 2027 se espera un índice de crecimiento promedio anual de 7,3 %.1 Entre otros factores, este crecimiento se debe al fuerte aumento de la demanda en relación con medicamentos y vacunas como consecuencia del COVID-19. La creciente necesidad de medicamentos para combatir enfermedades crónicas y relacionadas con el estilo de vida también está impulsando el crecimiento del mercado. Asimismo, otros factores determinantes son las continuas innovaciones en I+D, la implementación de nuevas terapias, las beneficiosas reformas sanitarias, el aumento de las ventas de medicamentos genéricos y la amplia demanda de los consumidores de medicamentos sin receta, como remedios para la tos y el resfriado, productos gastrointestinales y productos dermatológicos.
En relación con la dinámica del mercado se espera que la logística de la cadena de frío asuma un papel dominante en el mercado. Los requisitos de las terapias innovadoras, la creciente sensibilización de los consumidores y el aumento de la demanda de productos con temperatura controlada son tres factores clave que impulsan este cambio de paradigma hacia la logística de la cadena de frío con control de temperatura conforme a las directivas en todas las rutas de transporte[1]. Con el aumento de la demanda y la evolución de los requisitos, también se espera que las empresas involucradas garanticen una logística innovadora completa y excelente con una alta calidad de almacenamiento y de producto, cumpliendo tanto la estricta legislación como los requisitos GxP.
Las directrices OMS
Las “Buenas Prácticas de Almacenamiento y Expedición – Good Storage and Shipping Practices” (GSP), válidas en todo el mundo, publicadas por la Organización Mundial de la Salud (OMS), prevén la realización de pruebas, supervisión y registro de los medicamentos cuyas etiquetas indican determinadas condiciones de almacenamiento (por ejemplo, temperatura, humedad, etc.).
Las directrices específicas recomiendan el registro de la temperatura y la calibración periódica de los instrumentos de medición para garantizar la seguridad del producto. En el caso de las vacunas, particularmente, la OMS exige que cada ampolla se almacene en las condiciones especificadas y que existan sistemas adecuados de refrigeración, supervisión de temperatura y registro de datos.[2]
La Food and Drug Administration, FDA (Administración de Alimentos y Medicamentos de Estados Unidos – FDA) y la Agencia Europea de Medicamentos (EMA) recogen en sus directrices las pautas establecidas por la OMS y vigilan su cumplimiento.
Code of Federal Regulations – Código de Reglamenta ciones Federales (CFR)
El CFR – Título 21[3] abarca todas las normativas emitidas por la FDA para el tratamiento de alimentos y medicamentos. La normativa se aplica desde 1997 a todo aquel que almacene, transporte, fabrique o venda al por mayor medicamentos y los componentes necesarios para su fabricación.
En el 21 CFR parte 11, la FDA formula los requisitos para los registros electrónicos y las firmas electrónicas. Estos requisitos deben ser cumplidos por un sistema de monitorización ambiental automatizado para supervisar la temperatura y la hume- dad de los productos farmacéuticos.
En el 21 CFR parte 211 “Current Good Manufacturing Practice for Finished Pharmaceuticals” (Buenas prácticas de fabricación actuales para productos farmacéuticos terminados), describe el párrafo 211.42 los requisitos hacia los almacenes farmacéuticos. Éstos prevén el almacenamiento de los medicamentos en condiciones adecuadas referentes a la temperatura, humedad y luz para que la identidad, la eficacia, la calidad y la pureza del medicamento no se vean afectadas. Las prescripciones del CFR son complejas y extensas, pero pueden simplificarse en cuatro áreas principales de atención porque los componentes más críticos son también los esenciales: Cumplimiento de higiene, seguridad, temperatura y documentación.

21 CFR – Las cuatro áreas principales de atención
Higiene
El almacenamiento de productos farmacéuticos es limpio. Es lo suficientemente grande para asearse correctamente y sin espacios muertos en los que se pueden acumular suciedades o líquidos. Se han tomado precauciones para el control de plagas. Las zonas de almacenamiento en el suelo están señalizadas de forma inequívoca. Además, si es necesario, los límites de carga marcan la altura máxima de carga para que la circulación del aire no se vea perturbada aunque el vehículo esté cargado. El aislamiento del almacén cumple con las especificaciones. Existe una zona de cuarentena en caso de retiradas, reclamaciones, pro- ductos sospechosos o dañados.

Seguridad
La entrada al almacén se controla cuidadosamente y solo se permite al personal autorizado que lleve el equipo/ la ropa de protección adecuados. Un plan de seguridad exitoso incluye cámaras de vigilancia, una iluminación adecuada, llaves de control de acceso y puertas con cierre automático. Todos los empleados están capacitados para manipular productos farmacéuticos en todos los procesos que realizan.
Temperatura
La integridad de la cadena de frío se garantiza en el almacén. Si no se indican temperaturas de almacenamiento específicas para un producto, la temperatura debe mantenerse a una temperatura ambiente “controlada”. Es decir, la temperatura coincide con el entorno de trabajo común sin variaciones drásticas. El cumplimiento de los valores límite también se garantiza durante las operaciones de carga y descarga, así como en la zona de almacenamiento prevista para ello. 21 CFR parte 11 define las prescripciones del registro electrónico de temperatura.
Documentación
Durante el envío de medicamentos se realizan inspecciones de forma casi constante. En cuanto se recibe un recipiente de envío con medicamentos, se lleva a cabo un examen exhaustivo para detectar signos de contaminación. Los empleados están capacitados para reconocerlos, por ejemplo, palets rotos, láminas de embalaje rotas o pará- sitos, y rechazarán y documentarán la correspondiente aceptación de las mercancías. Todos los exámenes se protocolizarán.

USP 1079: Good Storage and Shipping Practices
Las “Buenas Prácticas de Almacenamiento y Expedición de Productos Farmacéuticos – Good Storage and Shipping Practices”, en el capítulo 1079 de la Farmacopea de Esta- dos Unidos (USP) prevén un sistema de gestión ambiental para los recintos donde se almacenan los medicamentos, la biotecnología y los instrumentos sanitarios.
El sistema de gestión ambiental debe controlar especial- mente la temperatura ya que esta puede perjudicar la pureza, la calidad y la seguridad de los productos almacenados. Los valores medidos deben documentarse con el fin de comprobar que los parámetros se han mantenido en el marco de las especificaciones para las mercancías. Las divergencias de las condiciones ambientales deben registrarse y luego corregirse.
Además, se prevé el uso de un número adecuado de registradores de temperatura para realizar un estudio de distribución de temperatura (mapping) y, a continuación, registrar continuamente las temperaturas de acuerdo con la distribución de temperatura.
Un sistema de advertencia debe prevenir que los productos almacenados se expongan a condiciones fuera de las especificaciones. Asimismo, las indicaciones generales recomiendan una revalidación anual de las zonas de almacenamiento para mantener un perfil preciso de las condiciones ambientales.[4]
La directiva UE GDP
Las directrices de las “Buenas Prácticas de Distribución – Good Distribution Practice” (GDP) formuladas por la Agencia Europea de Medicamentos (EMA) tienen como objetivo garantizar que todos los participantes en la cadena logística mantengan la calidad e integridad de los medicamentos exigidas por las GMP (“Good Manufacturing Practice – Buenas prácticas de fabricación”).
Las directrices GDP son vinculantes en el Espacio Económico Europeo desde septiembre de 2013 y son coordina- das y supervisadas por la EMA. Éstas prevén la existencia de equipos y procedimientos adecuados para mantener las condiciones de almacenamiento y distribución de los productos farmacéuticos en todo momento. Para ello, se deben registrar y documentar las condiciones ambientales para que, en caso necesario, se pueda demostrar que se han mantenido las condiciones correctas de temperatura y humedad a lo largo de toda la cadena de distribución.
Al igual que la USP 1079, la GDP europea exige que se realice un estudio fiable de la distribución de temperatura (mapping) antes de la instalación de un sistema de monitorización ambiental y que los componentes del sistema se coloquen de acuerdo con los resultados del mapping. Además, los equipos de control o supervisión de los parámetros ambientales requieren una calibración periódica en intervalos determinados. En caso de divergencias con respecto a los rangos de valores medidos prescritos, se deberá alertar a los responsables del lugar de almacenamiento.[5]
Una cadena de frío de productos farmacéuticos totalmente respetada y verificable no solo es importante para el bien- estar de los pacientes y los consumidores. Las infracciones contra los reglamentos pueden provocar pleitos jurídicos o pérdidas económicas considerables, por ejemplo en caso de demandas de indemnización o si se deben desechar preparados inservibles.
Supervisión del almacén conforme a GDP: Mantenimiento constante de la temperatura y la humedad.
Principalmente, tres factores pueden influir de forma negativa en la calidad, la eficacia y la caducidad de un medicamento durante el almacenamiento:
- Temperaturas altas o muy bajas
- Humedad ambiental alta
- Alta exposición a la luz
La razón para ello son especialmente las proteínas contenidas en muchos medicamentos. Las proteínas reaccionan de manera muy sensible a los cambios en las condiciones ambientales y, sobre todo, a las variaciones de temperatura.
En muchas ocasiones basta con que se incumpla el valor mínimo o el máximo una sola vez de las condiciones de almacenamiento requeridas para que se vea afectada la calidad del producto y, si el incumplimiento del valor límite es grave, incluso puede causar la pérdida de la eficacia. Además se pueden generar productos de desecho tóxicos que ponen en riesgo a los pacientes sobre todo en el caso de medicamentos de administración por vía parenteral. Si, además de unas condiciones de temperatura y humedad constantes, el medicamento también requiere una protección contra la luz, ésta suele estar garantizada por el embalaje.
Temperatura
Con la gran cantidad de requisitos de supervisión en los almacenes farmacéuticos, la temperatura es uno de los pará- metros de medición controlados con más frecuencia. Para la supervisión conforme a GxP de los productos farmacéuticos sensibles a la temperatura, se distinguen tres rangos de temperatura:
- Temperatura ambiente: 15 hasta 25 °C (pocas veces hasta 30 °C)
- Temperatura de refrigerador: 2 hasta 8 °C
- Temperatura de congelador: a -18 °C o más frío
La mayoría de los medicamentos pueden almacenarse a una temperatura ambiente hasta de 25 °C. Por el contrario, los productos biofarmacéuticos como la insulina tienen que refrigerarse obligatoriamente y requieren un nivel de temperatura constante. Incluso pequeñas divergencias de temperatura pueden causar daños.
Las vacunas hacen parte de los productos farmacéuticos especialmente sensibles a la temperatura. Con el tiempo pierden su eficacia y el calor acelera la pérdida de la eficacia. Los distintos tipos de vacunas difieren en su sensibilidad al calor y en la temperatura de almacenamiento prevista. Una insuficiencia de este rango de temperatura aumenta la reactogenicidad de la vacuna, es decir, aumentan los efectos secundarios.[6]
No solo medicamentos en sí y sus principios activos se pue- den dañar por fuera del rango de temperatura adecuado. Los recipientes o los embalajes también se ven afectados. Las fuertes variaciones de temperatura o las temperaturas bajo cero imprevistas pueden provocar grietas en las ampollas y los envases de vidrio o hacer que los componentes se disuelvan de los materiales de envasado. En consecuencia, es posible que se presenten impurezas e incluso la pérdida de esterilidad.

Humedad ambiental
Además de la temperatura, la humedad ambiental juega un papel muy importante en el almacenamiento seguro de productos farmacéuticos, y esto siempre en relación con la temperatura. La exposición de los productos farmacéuticos a la humedad debe minimizarse, controlarse y documentarse durante todo el proceso de producción. Las desviaciones de las condiciones de humedad deseadas también deben controlarse durante el almacenamiento y el depósito. Para evitar la pérdida de calidad, la humedad ambiental relativa debe mantenerse a un nivel constante de ≤ 60 %HR en condiciones de almacenamiento entre 15 y 25 °C.[7]
Condiciones de almacenamiento demasiado húmedas provocan la pérdida de calidad y que el medicamento no pueda utilizarse después. Pueden producirse embalajes mojados, etiquetas ilegibles y moho en las cajas de cartón.
Las condiciones de almacenamiento de los productos farmacéuticos pueden modificarse debido a diversos factores externos: Puertas y portones abiertos, convección, radiación solar, carga con mercancía nueva, sistemas HVAC (calefacción, ventilación, climatización) y muchos más. Por lo tanto, en el marco de un aseguramiento de la calidad en funcionamiento, es obligatorio registrar, supervisar y documentar tanto las temperaturas como la humedad ambiental relativa y su evolución. Solo así se contrarrestan las desviaciones oportunamente y se evitan daños. Según la ubicación, todos los almacenes farmacéuticos re- quieren diferentes estrategias de climatización y ventilación para poder reaccionar de forma específica a las divergencias de temperatura y humedad. Aunque el sistema de climatización de un almacén regula las condiciones ambientales, existen básicamente varias zonas de temperatura diferentes. Estas representan posibles puntos críticos de control que se verifican durante el mapping climático y son elementales en el posicionamiento óptimo del sistema de monitorización.

No deje nada al azar – Monitorización ambiental con la última tecnología de medición y servicios fiables
Testo le apoya con la última tecnología de medición conforme a las directivas y con servicios fiables para cumplir de forma segura con los requisitos de calidad necesarios y las exigencias oficiales, así como para reducir los riesgos al mínimo.
Los servicios y la tecnología se desarrollan continuamente junto con expertos del sector y se adaptan individualmente a los campos de aplicación en almacenes y centros de distribución, en la recepción de mercancías, en almacenes con estanterías altas, en cámaras frigoríficas y en refrigeradores, congeladores y refrigeradores de ultracongelación.
Planificación y ejecución de la cualificación del almacén
Con el fin de aplicar los requisitos de un almacén farmacéutico, Testo apoya en un principio la gestión de la cualificación basada en el riesgo. Las instalaciones de la zona de almacenamiento (DQ, IQ, OQ, PQ) se cualifican considerando los respectivos SOPs (Standard Operation Procedure – procedimientos operativos estándar) así como medidas generales para la garantía de la calidad. Esto significa que se demuestra que los elementos técnicos están correctamente diseñados (DQ) e instalados según lo planificado (IQ), así como que cumplen la funcionalidad (OQ) y proporcionan el rendimiento (PQ) previsto.
Explicación de los conceptos – DQ, IQ, OQ, PQ
- DQ Design Qualification
- IQ Installation Qualification
- OQ Operational Qualification
- PQ Performance Qualification
Cálculo de la distribución de temperatura y humedad
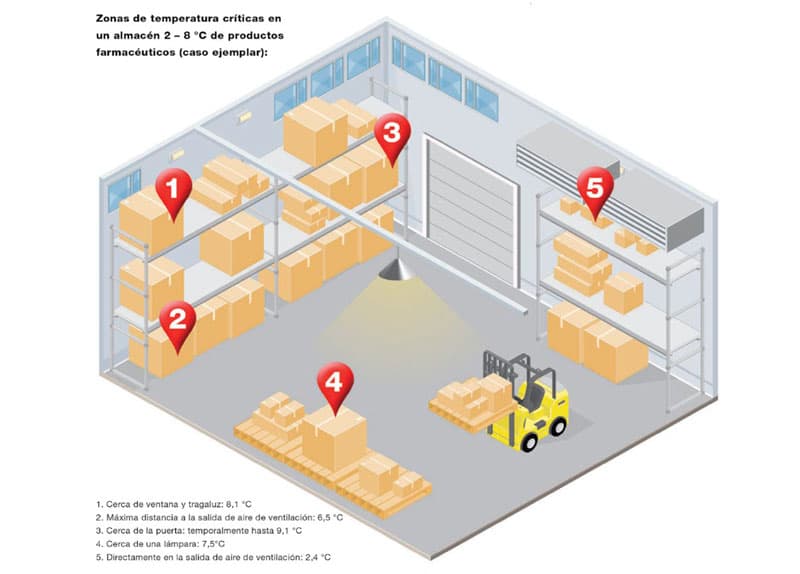
Para garantizar una medición fiable de los valores de temperatura y humedad en las zonas de almacenamiento, los puntos críticos de medición se determinan mediante estudios de distribución de la temperatura y la humedad. Además, se realizan pruebas de estrés adicionales para revelar los límites de rendimiento del sistema de climatización. Las zonas de almacenamiento en las que se observan fluctuaciones o extremos de temperatura y humedad que pueden afectar negativamente a la calidad de los productos farmacéuticos almacenados se identifican como puntos críticos de control (CCP).La distribución de temperatura es un reto en muchos almacenes. Además de los gradientes de temperatura en estanterías altas entre el aire frío en la zona del suelo y el aire calienteen las cercanías del techo, muchos otros factores influyen en la distribución de temperatura dentro y fuera del edificio.Por lo tanto, al verificar la distribución y el mantenimiento de la temperatura y la humedad dentro del almacén, también se determina la estabilidad y la robustez del almacén frente a las influencias externas. Entre estos factores de influencia se encuentran el tamaño del almacén, la carga, el mobiliario, las aberturas, las entradas de luz, así como la tecnología de calefacción, climatización y ventilación. En algunas zonas climáticas de la tierra también se deben considerar las variaciones estacionales en el momento de registrar la distribución de temperatura y humedad. Las mediciones de verano e invierno son necesarias, respectivamente, para verificar las condiciones ambientales dentro del almacén y su influencia a través de las temperaturas ex- ternas predominantes. Al medir la distribución de temperatura, debe prestarse especial atención a las zonas de almacenamiento en las que sea más probable que se produzca una desviación de la temperatura, como se muestra en el ejemplo de la página 6. Esto incluye, en particular, los muelles de carga y todas las zonas de almacenamiento cercanas a los dispositivos de calefacción, los tragaluces, las puertas, las ventanas y las paredes exteriores, especialmente en el lado sur o norte del edificio. En el marco de un proceso de mapping, estas zonas de almacenamiento están equipadas con registradores de datos que cumplen con las normas GxP durante un período de tiempo más largo, que registran y documentan continuamente las condiciones de temperatura. Posteriormente, con los datos obtenidos se crea un perfil climático integral para el almacén. Con la identificación de los CCPs, los sensores testo Saveris Pharma pueden colocarse e instalarse exactamente en los puntos que deben ser vigilados y controlados de forma permanente. Además, el éxito del mapping ofrece la ventaja de que el perfil de las condiciones creadas del almacén reduce considerablemente el tiempo de instalación del sistema de monitorización ambiental para la supervisión permanente.

Instalación del sistema de monitorización ambiental
Los siguientes pasos incluyen la planificación, montaje y puesta en marcha de los componentes del sistema testo Saveris Pharma. Estos se recopilan de tal manera que todos los puntos de medición críticos determinados en la distribución de temperatura y humedad se cubren y se supervisan permanentemente.
Si la instalación se lleva a cabo en un almacén de estanterías elevadas, los sensores testo Saveris Pharma se colocan en diagonal sobre las filas de estanterías para proporcionar una vista general tridimensional de los valores de temperatura y humedad de la zona de almacenamiento. Estos patrones de disposición proporcionan un perfil completo del almacén de las estanterías elevadas.
En las instalaciones de almacenamiento en bloque, así como en las cámaras frigoríficas y de congelación, los productos farmacéuticos suelen almacenarse a alturas poco relevantes. Aquí los sensores testo Saveris Pharma se montan sin diferencias de altura. Si se utilizan elementos del sistema de radiocomunicación, recomendamos medir la señal de radio antes de la instalación para garantizar que las extensas zonas de almacenamiento se supervisen de forma fiable.

Calibración y validación
Tras la instalación del sistema testo Saveris Pharma, un detallado Site Acceptance Test (SAT) confirma la funcionalidad de los componentes del sistema utilizados. La calibración inicial de las sondas testo Saveris Pharma se realiza antes de la entrega en nuestros laboratorios de calibración acreditados en puntos de calibración típicos para la aplicación con certifica- dos de calibración trazables.
Para el cumplimiento de la conformidad con 21 CFR parte 11, el sistema se valida a continuación en el SAT. La validación confirma que el sistema de monitorización ambiental instalado cumple las tareas definidas de manera repetible y reproducible.
Servicios postventa
Además de la asistencia técnica, Testo también se encarga de la recalibración y revalidación de las sondas tras los cambios críticos del sistema. De este modo, el sistema puede ampliarse en cualquier momento según las necesidades.
Las ventajas del sistema testo Saveris Pharma para la monitorización ambiental de productos farmacéuticos.
La solución completa testo Saveris Pharma se encarga de la supervisión automatizada y continua de la temperatura y la humedad en almacenes de productos farmacéuticos con tecnología de medición de alta precisión, software de manejo intuitivo y amplios servicios GxP. Además, el sistema convence con las siguientes ventajas:
Componentes del sistema específicos de la aplicación
Los robustos y altamente precisos registradores de datos testo Saveris Pharma registran incluso pequeños cambios de temperatura y humedad ambiental relativa. Los distintos modelos de los registradores de datos pueden ensamblarse y colocarse a partir de módulos individuales según el principio modular para adaptarse a la aplicación específica.
Testo Saveris Pharma garantiza una supervisión eficiente gracias a la conexión de hasta cuatro sondas a un registrador de datos. La amplia gama de sondas satisface todos los requisitos de temperatura y humedad imaginables y permite una supervisión segura incluso de zonas de difícil acceso, entornos de almacenamiento con mayor circulación y las aplicaciones de refrigeración y congelación.
Gracias a los componentes individuales del sistema, testo Saveris Pharma puede integrarse de forma flexible y preparada para el futuro en la arquitectura del edificio del almacén y soporta la ampliación sin complicaciones del almacén o del sistema de monitorización ambiental con puntos de medición adicionales o el reposicionamiento de las sondas, por ejemplo en el marco de una remodelación del almacén con revalidación.
Seguridad de datos sin compromiso
Gracias al almacenamiento redundante y triple de los valores medidos registrados, testo Saveris Pharma ofrece la mayor seguridad de datos posible. Todos los datos de medición registrados se transmiten inmediatamente desde los registra- dores de datos a la estación base con el siguiente ciclo de comunicación y allí también se almacenan temporalmente.
En el software GxP validable testo Saveris Pharma como la última de tres instancias, todos los valores medidos se almacenan y archivan de forma centralizada. Incluso en caso de un apagón eléctrico, el registro de datos con testo Saveris Pharma no se interrumpe. Además, las sondas digitales ofrecen la gran ventaja de que un cambio de sondas necesario para la calibración puede llevarse a cabo en segundos y sin vacíos de datos en la documentación durante el funcionamiento. No se requiere desmontar los registradores de datos y tampoco surgen vacíos de los valores medidos.
Versatilidad con bajos costes operativos
La versatilidad del sistema testo Saveris Pharma permite utilizar diferentes infraestructuras de comunicación como WLAN, Ethernet o la tecnología por radio de última generación testo UltraRange para una comunicación segura y eficiente a larga distancia en una red propia. La combinación de componentes de sistemas de radio y Ethernet permite supervisar amplias zonas de almacenamiento de forma fiable. Además, existen varias opciones de conectividad – por cable, POE (Power-over-Ethernet) o pilas -, lo que permite reducir los costes operativos.
- Conformidad: Aseguramiento de la integridad de los datos y prevención de vacíos innecesarios en la documentación.
- Transparencia: Todos los parámetros ambientales a la vista y reacción rápida gracias a las alertas.
- Eficiencia: Amplios servicios GxP y un sistema que cumple con los requisitos.
- Confiabilidad: Enfrentar auditorías con destreza gracias una solución fiable de un socio profesional.

Alerta remota a toda hora
Un buen programa de garantía de calidad, así como aprobar las inspecciones de GxP por parte de las autoridades sanitarias, requiere un amplio sistema de alarmas y procedimientos consolidados para gestionar las variaciones y las incumplimientos del valor límite de las condiciones ambientales. El sistema testo Saveris Pharma forma una densa red de supervisión del lugar de almacenamiento e informa a los operarios inmediatamente de cualquier riesgo y también en caso de apagón eléctrico a través de varios canales de comunicación.
Las diversas posibilidades de alarma conformes a GxP, por ejemplo, a través de SMS o correo electrónico, garantizan que nadie tenga que esperar a ver el LED rojo de advertencia de los registradores de datos. Las condiciones ambientales divergentes y los incidentes críticos del sistema pueden ser vistos por los responsables desde cualquier dispositivo móvil (smartphone, tablet, PC), independientemente de su ubicación. La alerta remota permite una reacción rápida para prevenir daños antes de que se produzcan.
Documentación automatizada
testo Saveris Pharma genera registros de datos digitales continuos y protegidos. La tecnología de medición moderna ya no contempla la lectura y el almacenamiento manual de los datos de medición. Así, la solución completa no solo reduce la cantidad de trabajo que supone llevar registros escritos, sino que también elimina los errores asociados a la documentación manual. Los informes totalmente automatizados (Audit Trails) cumplen las prescripciones GxP y pueden presentarse durante las inspecciones. Con el Cockpit testo Saveris Pharma puede ver, confirmar y comentar las alarmas y las curvas de medición respectivas en cualquier momento y desde cualquier lugar.
Análisis de datos optimizado
La disponibilidad digital de los datos y el sistema automatizado de informes permiten un análisis eficaz de las curvas de medición, así como la distribución digital a los responsables.
Los informes históricos de fácil creación y los historiales de tendencias pueden convertirse en un aspecto importante de los procesos de auditoría. El contenido de los informes puede adaptarse al destinatario correspondiente (el Audit Trail también debe enviarse). Y también es posible exportar un archivo a Microsoft Excel para otros análisis.
testo Saveris Pharma también determina la MKT (mean kinetic temperature – temperatura cinética media) y proporciona un informe especial de MKT que muestra el efecto global de las variaciones de temperatura en los productos almacenados.
Servicios conformes a GxP y documentación completa
Para establecer de manera eficiente y fiable una supervisión, validación y cualificación de un lugar de almacenamiento de mercancías farmacéuticas se recomienda trabajar con especialistas. Los documentos de cualificación rápidos y sencillos (DQ, IQ, OQ, PQ), así como los servicios de instalación, calibración y validación in situ, garantizan una puesta en marcha sin problemas y una documentación completa.
Alta tecnología de la Selva Negra.
Desde hace más de 60 años, Testo es sinónimo de innovadoras soluciones de medición “Made in Germany”. Como líder mundial en la tecnología de medición portátil y estacionaria brindamos apoyo a nuestros clientes para ahorrar tiempo y recursos, proteger el medio ambiente y la salud de las personas y aumentar la calidad de las mercancías y los servicios.
En las 34 filiales distribuidas por todo el mundo, más de 3000 empleadas y empleados investigan, desarrollan, producen y comercializan para nuestra empresa de alta tecnología. Testo convence a más de 1 millón de clientes a nivel mundial con analizadores de alta precisión y soluciones innovadoras para la gestión de datos de medición del mañana. Un promedio de crecimiento anual por encima del 10 %, desde su fundación en 1957, y una facturación actual de casi 300 millones de euros demuestran claramente que la región de la Selva Negra es completamente compatible con la creación de sistemas de alta tecnología. La clave del éxito de Testo es una inversión superior a la media en el futuro de la empresa. Testo invierte alrededor de una décima parte de la facturación anual en Investigación y Desarrollo.