
Nueva Columna Cromatográfica Iónica
Versatilidad, robustez y exactitud. Análisis de carbohidratos y glifosato.

La nueva columna cromatográfica Metrosep Carb 2 destaca por su alta capacidad de intercambio iónico, y por tanto, por el alto número de grupos funcionales presentes en su fase estacionaria, permitiendo así obtener una excelente separación de los diferentes azúcares y carbohidratos en estudio. Las aplicaciones abarcan una amplia gama de posibilidades analíticas en diferentes áreas: análisis de agua y ambiente, industria farmacéutica y de alimentación, estudios forenses, industria cosmética, así como el control de calidad de biocarburantes.
Además de proporcionar el análisis de carbohidratos también es una columna apta para la determinación de aniones en muestras con alto contenido salino, donde otras columnas de más baja capacidad fracasan (ejemplo: determinación de aniones en aguas de mar).
Presentamos dos trabajos realizados con la columna cromatográfica Metrosep Carb 2: Determinación de Carbohidratos en jugo de manzana y en leche deslactosada y Determinación de glifosato y su metabolito en aguas.
¿Está hecho de azúcar?

Los carbohidratos constituyen la mayor parte de la biomasa sobre la Tierra: son producto de la fotosíntesis y forman parte de todas las plantas y de todos los materiales de origen vegetal. La cantidad y la composición de los carbohidratos contenidos en una muestra ofrecen, según el contexto, gran cantidad de información sobre ésta. Por dicha razón, son objeto principal de análisis en diferentes áreas de trabajo.
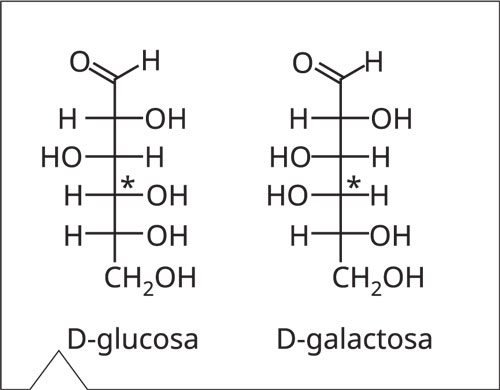
Figura 1. Fórmula estructural de glucosa y galactosa. Las moléculas se diferencian solo por la posición de los grupos OH ligados al átomo C4 (marcado con asterisco).
Los carbohidratos están en todas partes
En la industria de la alimentación, el contenido de azúcares y carbohidratos son factores principales en la determinación del valor nutricional de alimentos y bebidas. En el análisis ambiental -por mencionar un ejemplo- el azúcar anhidro levoglucosano, producido por la pirólisis de celulosa, es analizado en aerosoles, actuando así como marcador para detectar combustión de biomasa. Estos son tan solo dos ejemplos acerca de las muchas aplicaciones en el análisis de carbohidratos.
Los carbohidratos están formados por una o varias unidades de monosacáridos, los cuales contienen un grupo carbonilo (grupo aldehído o cetona) y varios grupos hidroxilo [1]. Debido a que los mono-, di- y oligosacáridos son solubles en agua, la cromatografía iónica es una técnica especialmente adecuada para su análisis, ya que opera principalmente en fase acuosa. De esta forma no se requiere una extracción de los analitos en fase orgánica, por lo cual, la determinación puede realizarse directamente.
Se precisa de una columna cromatográfica de intercambio aniónico de alta capacidad, porque los azúcares son moléculas relativamente grandes, y en muchos casos presentan estructuras muy similares (por ejemplo, glucosa, y galactosa, véase Figura 1). Por esta razón, Metrohm ofrece la nueva columna Metrosep Carb 2.
Azúcares en alimentos
A partir de diciembre de 2016 la Unión Europea requiere la declaración del valor nutricional en la etiqueta de todos los productos alimenticios, con excepción de productos no procesados y los vendidos a granel (Decreto No. 1924/2006). Con ello será requerido lo que hoy en día ya se practica habitualmente, es decir la información sobre el valor calórico y el contenido de algunos componentes nutricionales, entre ellos azúcar y carbohidratos. Además del almidón, polímero de glucosa, los carbohidratos «disponibles», es decir los carbohidratos digeribles por los humanos, se encuentran en su mayoría en forma de azúcares. De acuerdo con la definición realizada por la UE son incluidos los mono- y disacáridos con la excepción de los alcoholes polivalentes. La mayoría de los azúcares presentes en los alimentos son los monosacáridos glucosa, fructosa y galactosa, así como los disacáridos sacarosa, lactosa y maltosa.
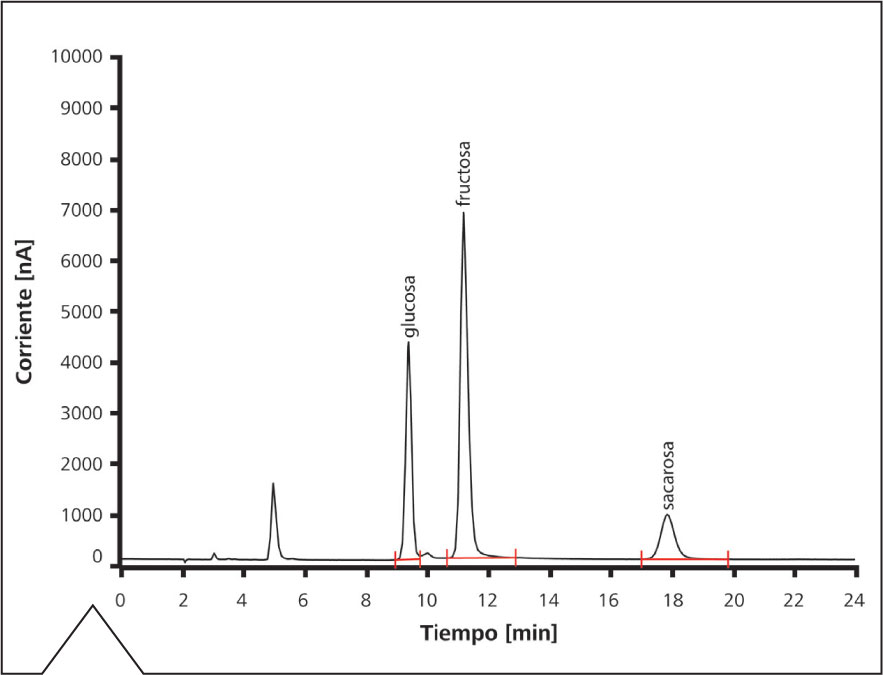
Figura 2. Determinación de glucosa, fructosa y sacarosa en jugo de manzana. Aparte de una simple dilución, no es necesaria una preparación adicional de la muestra.
Análisis de jugo de manzana
El cromatograma de la Figura 2 se ha obtenido mediante el análisis de jugo de manzana, el cual ha sido diluido con agua ultrapura (Tipo I). No es necesaria una preparación adicional de la muestra. El eluyente alcalino utilizado (100 mmol/L hidróxido de sodio : 10 mmol/L acetato de sodio) facilita la presencia de los azúcares en su forma disociada (como aniones), pudiendo ser por tanto separados por una columna cromatográfica mediante el mecanismo de intercambio iónico.
Debido a que los carbohidratos son sustancias electroquímicamente activas, pueden ser detectados amperométricamente. Durante la detección amperométrica los analitos son oxidados en la superficie del electrodo de trabajo sobre el cual se aplica el correspondiente potencial de medida. Esta oxidación del analito proporciona una corriente directamente proporcional a su concentración.
Debido a que si se aplica un potencial constante durante cierto tiempo se formarían depósitos sobre el electrodo de trabajo, el detector es operado en el modo PAD (Pulsed Amperometric Detection detección por amperometría pulsada). Este método se basa en la aplicación de tres potenciales diferentes, los cuales se repiten cíclicamente. De esta forma, después de la toma de medida de corriente, el electrodo de trabajo se limpia y acondiciona de forma cíclica y automática.
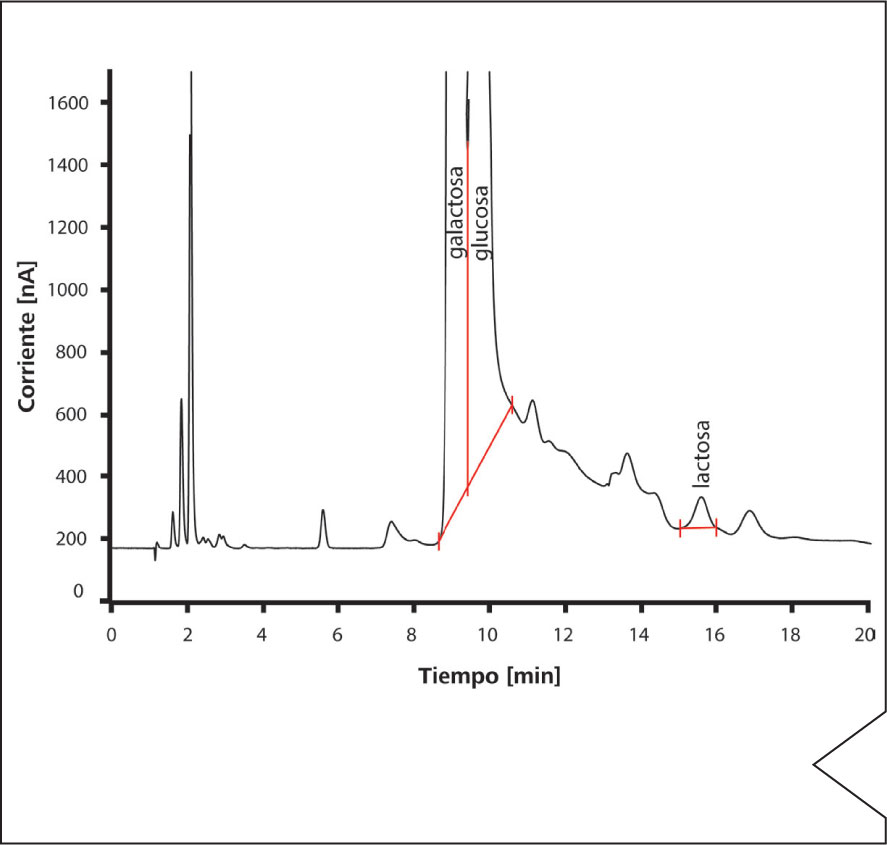
Figura 3. Determinación de lactosa residual en leche declarada como deslactosada y fortificada previamente con 100 mg/L de lactosa.
Lactosa residual en productos deslactosados
El ensayo principal en el control de calidad de productos definidos como deslactosados es la determinación de lactosa residual. El cromatograma de la Figura 3 muestra la determinación de lactosa en leche deslactosada, habiendo sido enriquecida previamente con 100 mg/L de lactosa. De nuevo la separación se realiza en medio alcalino (eluyente 5 mmol hidróxido de sodio : 2 mmol acetato de sodio), y la detección mediante amperometría pulsada. Las altas concentraciones de galactosa y glucosa visibles en el cromatograma son el resultado de la hidrólisis enzimática de la lactosa en estos dos monosacáridos (Figura 4).
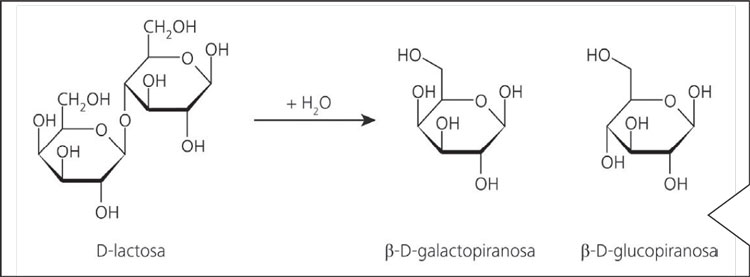
Figura 4. La lactosa está compuesta por los monosacáridos galactosa y glucosa. La hidrólisis enzimática de la lactosa aquí ilustrada es realizada por la enzima lactasa.
Debido al alto contenido en proteínas presentes en la muestra de leche, ésta debe ser dializada previamente a su análisis. Este paso se realiza de forma totalmente automatizada a partir de la técnica de preparación automática de muestras: Metrohm Inline Sample Preparation, y no requiere tarea adicional alguna por parte del analista.}

Figura 5. El levoglucosano (1,6-anhidro-ß-D-glucopiranosa) se genera por la pirólisis de celulosa y por eso es utilizado como trazador para la detección de la combustión de biomasa.
Los carbohidratos como marcadores en el análisis ambiental
En muchos casos se sobrepasan los valores umbrales de aerosoles de bajo tamaño de partícula, establecidos para la protección de la salud. En la mayoría de los casos los principales causantes son el transporte y la industria, pero también se ha identificado la quema de madera para la calefacción en viviendas familiares como un posible causante de su presencia [2].
Para detectar la quema de madera, el levoglucosano es empleado como marcador (Figura 5). La Figura 6 muestra la determinación de una solución patrón, en la cual, a parte de levoglucosano, se analizan también manosano y galactosano – siendo éstos también productos resultantes de la combustión de biomasa – así como varios azúcares y alcoholes de origen biológico, que típicamente se encuentran sobre partículas aerosoles. El empleo de una columna de alta capacidad como la Metrosep Carb 2 proporciona una separación excelente de todas estas especies, pudiendo ser así determinadas a partir de un único análisis.
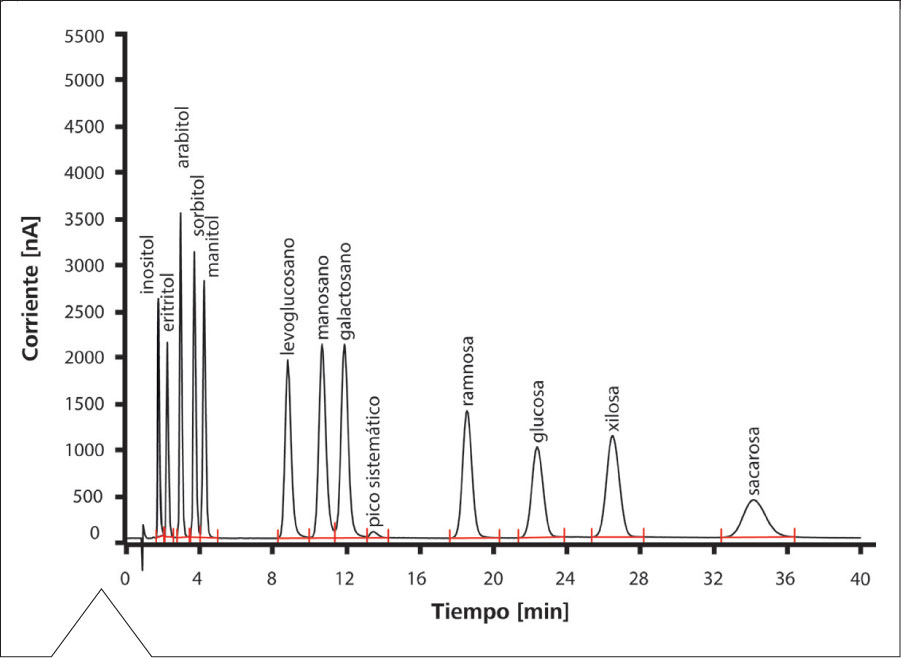
Figura 6. Determinación de marcadores de la combustión de madera (levoglucosano, manosano y galactosano) y de azúcares y alcoholes de origen biológico, presentes en aerosoles como el polen.
Referencias
- Ebermann, R. und Elmadfa, I. (2008): Lehrbuch Lebensmittelchemie und Ernährung. Springer-Verlag/Wien.
- Bundesinstitut für Risikobewertung (2015): «Analyse des quantitativen Ein-flusses der Holzverbrennung auf die Feinstaubkonzentration in Berlin und Brandenburg anhand des Tracers Le-voglucosan». Bajado el 18.05.2015 de http://www.bfr.bund.de/de/analyse_des_ quantitativen_einflusses_der_holzver-brennung_auf_die_feinstaubkonzentra-tion_in_berlin_und_brandenburg_an-hand_des_tracers_levoglucosan__levo-glucosan_-193056.html.

Glifosato y AMPA en agua potable
Determinación por cromatografía iónica con detección amperométrica pulsada
La Agencia Internacional para la Investigación del Cáncer ha publicado en marzo del 2015 un reporte en el cual se ha caracterizado el glifosato como “probablemente cancerígeno para humanos”. Esto ha iniciado un debate acalorado sobre su uso. En algunos países, entre otros los EE. UU. y Australia, ya existen valores límites para el herbicida.
¿Cancerígeno o no?
El herbicida de banda ancha glifosato se utiliza en la agricultura en todo el mundo. Además de su uso en la agricultura, también se lo aplica en jardines privados, así como en áreas públicas o privadas en las cuales se debe evitar un desarrollo excesivo de la vegetación, por ejemplo, en las vías férreas. EI glifosato se utiliza desde los años 1970 en los productos fitosanitarios, y ha sido considerado hasta el momento como inocuo en las cantidades de exposición típicas. Pero, después de que la Agencia lnternacional para la lnvestigación del Cáncer (IARC por sus siglas en inglés), agencia de la OMS especializada en la investigación del cáncer, lo haya clasificado como “probablemente cancerígeno para humanos” (Grupo 2A) en una publicación de marzo de 2015, el producto ha ocupado los titulares frecuentemente [1]. Los expertos debatieron la cuestión de si el glifosato debería ser reautorizado en la UE después de la expiración de la autorización anterior el 30 de junio 2016 – ya que, a diferencia de la IARC, la Autoridad Europea para la Seguridad de los Alimentos (EFSA) recientemente declaró que fue improbable que el glifosato fuera cancerígeno o genotóxico [2]. Por ahora, la autorización se ha prorrogada por 18 meses, cuando aparecerá nuevamente la pregunta si el uso del glifosato quedara permitido en la Unión Europea.
Valores límites del glifosato en agua potable
Como los compuestos utilizados en la agricultura pueden migrar desde el suelo al agua subterránea, existen valores límites en algunos países para el glifosato en el agua potable. Así por ejemplo la Agencia Protección Ambiental de los EE UU, la EPA, exige un valor máximo de 700 µg/L. En Canadá el valor es de 280 µg/L. En Australia rige un valor límite sensiblemente inferior que asciende a 10 µg/L.
EI glifosato y su metabolito el AMPA (ácido alpha-amino-3-hidroxi-5-metilo-4-isoxazolpropiónico) se determinan generalmente según el método EPA 547, mediante HPLC con una derivatización post-columna y una detección por fluorescencia. También es posible mediante cromatografía iónica acoplada a un detector selectivo de masa. En este trabajo se presentan los resultados de la determinación del glifosato y AMPA en agua potable mediante la cromatografía iónica (IC) con detección amperométrica pulsada. Se alcanzaron límites de detección en el rango bajo de µg/L. Los límites de detección para el glifosato y AMPA previamente obtenidos con detección amperométrica pulsada estaban en el rango de ≥50 µg/L [3]. Con este incremento de la sensibilidad, el método presentado es apto para el cribado del glifosato y AMPA en muestras de agua y alimentos.

Figura 1: Se han determinado el glifosato y AMPA con el sistema ProflC Vario 1 Amperometry.
Instrumentación
Todas las determinaciones se han realizado con un sistema IC, constituido por un cromatógrafo iónico “940 Professional IC Vario ONE” acoplado a un detector amperométrico “IC Amperometric Detector” y un procesador de muestras “858 Professional Sample Processor” para la inyección automática de las muestras (ver la figura 1). La medida se ha realizada con el detector amperométrico en el modo flexlPAD (FLEXible Integrated Pulsed Amperometric Detection) operado con un electrodo de trabajo de oro. El flexlPAD es un perfil de potencial de varios escalones. En la determinación del glifosato y AMPA, proporciona una señal estable durante un periodo más largo que el perfil de potencial PAD (Pulsed Amperometric Detection) regular de tres escalones. El perfil de potencial aplicado en un ciclo de medida en el modo fIexIPAD se muestra en la figura 2.
El glifosato y el AMPA se han separado mediante una columna de separación de aniones de alta capacidad, la Metrosep Carb 2. EI eluyente de soda caustica y acetato contenía 10 mmol/L hidróxido de sodio y 300 mmol/L acetato de sodio.
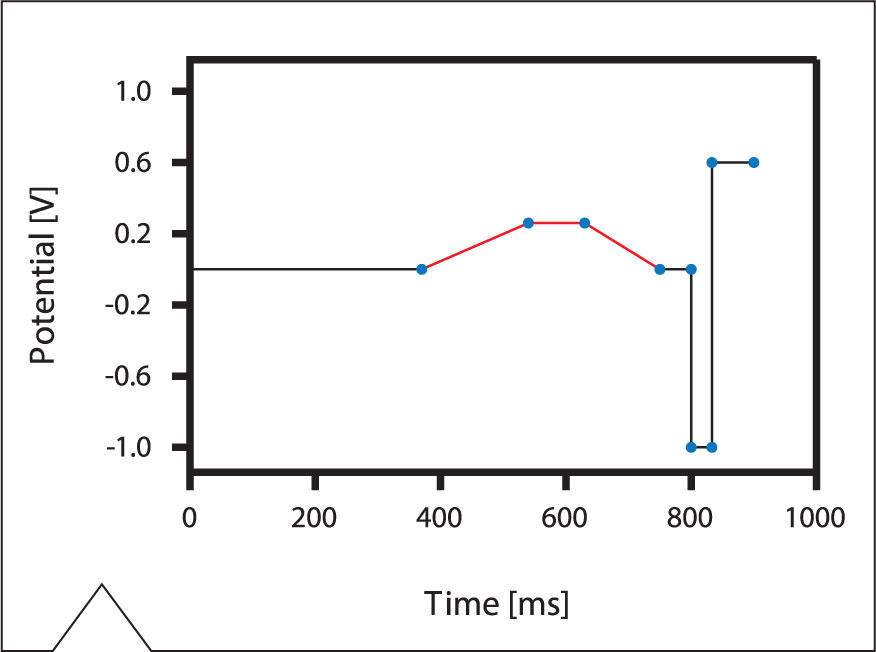
Figura 2: Perfil de potencial del modo de detección flexlPAD. Un ciclo de medida tarda 0.9 s, la medida de la corriente se realiza durante la fase trazada en rojo.
Parte experimental
La meta de este trabajo fue investigar la separación de glifosato y AMPA mediante una columna de separación Metrosep Carb 2, así como estudiar la detección por amperometría pulsada y su sensibilidad. La columna Metrosep Carb 2 se utiliza sobre todo para la separación y determinación de carbohidratos, alcoholes de azúcar, alcoholes, etc. El alto valor de pH del eluyente de aproximadamente 10 también es típico para el análisis de azucares. La alta capacidad de la columna en conjunto con el alto valor de pH del eluyente resulta en una gran diferencia del tiempo de retención entre el AMPA y el glifosato. Esto se debe a que, con un valor de pH de 10, los tres grupos ácidos están desprotonados en parte del glifosato, por lo cual está presente como anión trivalente, mientras que el AMPA, al cual le falta el grupo carboxílico, está presente como anión divalente.
Como el glifosato es retenido mucho más fuertemente que el AMPA, se ha aplicado un gradiente de flujo para acelerar su elución: después de la elución del AMPA a los 6,4 minutos, se duplica el flujo de 0,4 mL/min a 0,8 mL/min. Con ello se obtiene un tiempo de retención para el glifosato de 21 minutos. Las condiciones cromatográficas se encuentran en la tabla 1.
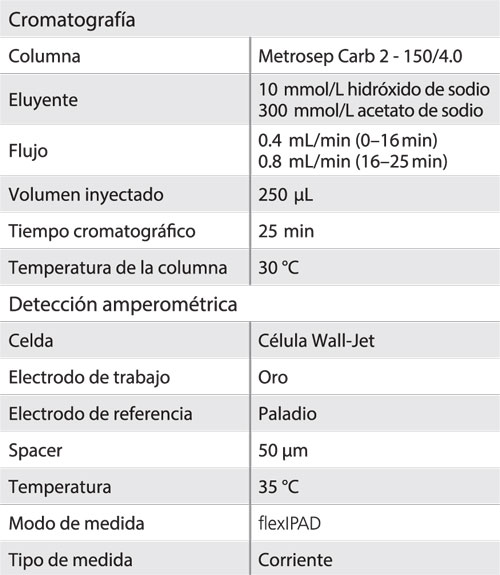
Tabla 1: Condiciones cromatográficas
Resultados
En la figura 3 se muestra el cromatograma de la determinación del AMPA y el glifosato bajo las condiciones documentadas en la tabla 1. Se ha inyectado una solución patrón acuosa enriquecida con 10 µg/L de ambos compuestos. Para comprobar la aptitud del método para los análisis de agua potable, se ha analizado el agua de la comunidad de Herisau (Suiza), el cual también se ha enriquecido con cantidades diferentes de AMPA y glifosato. Las concentraciones y áreas de los picos medidos se presentan en la tabla 2.
Los límites de detección para ambos compuestos fueron determinados a partir de la relación señal ruido (S/N), es decir la relación entre la altura del pico y el ruido de la línea de base. Para el límite de detección, la relación S/N es de 3. Si cae por debajo de 3, no es posible asegurar una determinación. EI límite de detección alcanzado para el AMPA está considerablemente inferior a 1 µg/L, y para el glifosato está cerca del 1 µg/L. En la figura 4 se muestra el cromatograma del agua potable enriquecido con 2 µg/L de glifosato y AMPA.
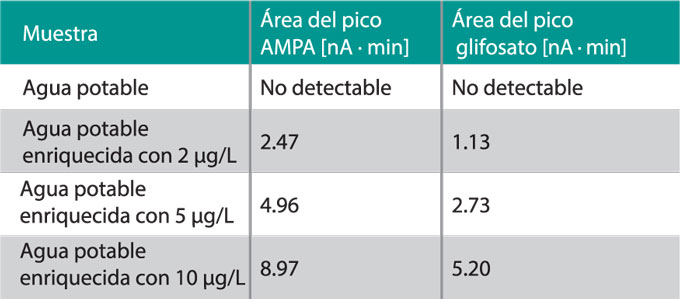
Tabla 2: Muestras de agua potable y áreas [nA x min] detectados
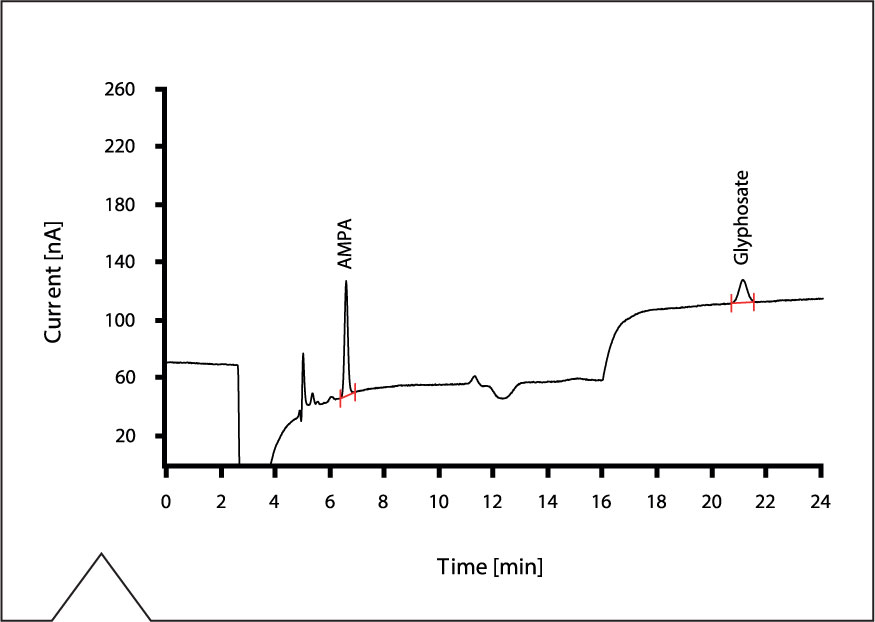
Figura 3: Separación del AMPA y glifosato: Se ha analizado una solución estándar con 10 µg/L de ambos compuestos en agua ultrapura. Las condiciones se detallan en la tabla 1.
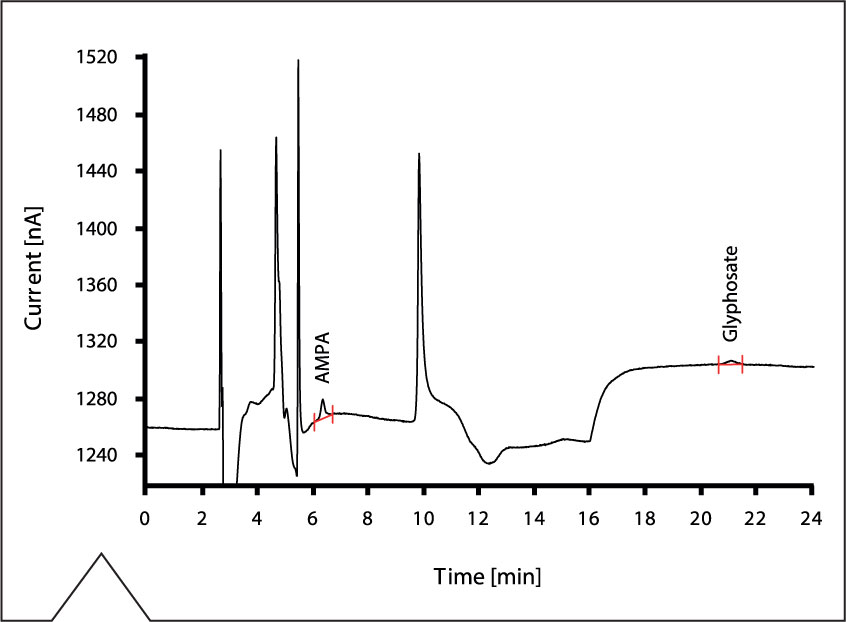
Figura 4: Determinación del AMPA y glifosato en agua potable enriquecido con 2 µg/L de ambos compuestos. Para las condiciones y resultados, vea las tablas 1 y 2.
Conclusiones
Se muestra por primera vez la determinación del glifosato y su metabolito primario el AMPA en agua potable mediante la IC con detección amperométrica pulsada flexlPAD en el rango bajo de µg/L. Con esto es posible una determinación fiable de glifosato y AMPA en agua y alimentos y, de una manera económica, en comparación con HPLC con detector selectivo de masa. Con el límite de detección de aproximadamente 1 µg/L, el método puede ser utilizado para vigilar el cumplimiento de los valores límites del glifosato en los EE. UU., Canadá y Australia, entre otros.
Referencias
[1] IARC Monographs Volume 112 (2015). Retrieved from http://monographs.iarc.fr/ENG/Monographs/voI112/mono112-09.pdf on 27 June 2016.
[2] EFSA press news, 151112 (2015). Retrieved from http://www.efsa.europa.eu/en/topics/factsheets/glyphosate1S1112 on 27 June 2016
[3] F. Sanchez-Bayo, R.V. Hyne, and K.L. Dessei- lle (2010) Anal. Chim. Acta, 675 125—131













