
Cuantificación de N-glicanos liberados de mAb usando columna Accucore 150 HILIC Amida

Autores: Xin Zhang, Xuefei Sun
Thermo Fisher Scientific, Sunnyvale, CA, USA
Beneficios de la Aplicación
- Reproducibilidad intra e inter columna en tiempo de retención comprobada, y forma de pico maximizada con RSD <2% entre corridas y RSD <7% lote a lote.
- El uso de columnas con partículas de núcleo sólido resulta en contrapresiones moderadas compatibles con equipos HPLC y mayores eficiencias de separación
- Cuantificación exacta y precisa de N-glicanos de IgG humano con un % de sesgo promedio absoluto del 3%
- Excelente correlación con un método de cuantificación completamente validado (R2> 0.99 para la regresión de Deming)
Objetivos
Demostrar la robustez, reproducibilidad, exactitud y precisión durante la cuantificación de N-glicanos de IgG con el sistema biocompatible integrado Vanquish™ Horizon UHPLC de Thermo Scientific™ y la columna Thermo Scientific™ Accucore™ 150 Amida HILIC.
Introducción
Más de dos tercios de los productos biofarmacéuticos recombinantes en el mercado son glicoproteínas, y cada etapa de su fabricación se monitorea y prueba cuidadosamente para garantizar la consistencia en calidad, seguridad y efectividad1 .
El patrón de glicosilación es uno de los “atributos clave de calidad crítica” (CQAs, sigla en inglés) de los productos bioterapéuticos basados en anticuerpos monoclonales (mAb). Los cambios en la glicosilación pueden afectar la seguridad, la eficacia, el clearence y la inmunogenicidad de un medicamento biológico, por lo que es imprescindible detectar los cambios con precisión. Es por esto que deben incluirse métodos robustos, ricos en información y reproducibles para el análisis de glicanos en las presentaciones reglamentarias de productos bioterapéuticos a base de glicoproteínas para garantizar la efectividad de los tratamientos terapéuticos2. Los métodos actuales de análisis de glicanos incluyen la preparación de muestras, seguidos de electroforesis capilar de alto rendimiento (HPCE) o por cromatografía líquida de alto rendimiento (HPLC). La preparación de la muestra incluye técnicas como desnaturalización de proteínas, desglicosilación enzimática, marcaje con colorantes y la eliminación de la matriz en exceso, lo cual puede tomar desde algunas horas hasta varios días de preparación.
Los métodos de separación de glicanos suelen aislar moléculas y sus fragmentos en función de diferentes propiedades físicas con HPCE o cromatografía de interacción hidrofílica (HILIC).
Los métodos de cromatografía líquida usando detección de fluorescencia (LC-FLD) se han utilizado ampliamente para el análisis de glicanos, lo que permite muy buena reproducibilidad3 en la cuantificación relativa de glicanos en una muestra. Las fases estacionarias para U/HPLC de tipo HILIC basadas en amidas son una técnica sólida y bien establecida empleada por muchos laboratorios para obtener alta resolución en las separaciones de los N-glicanos liberados de las glucoproteínas. Etiquetar los glicanos con una sonda fluorescente como 2-AB (2-aminobenzamida), 2-AA (ácido 2- antranílico) o APTS (sal de trisodio del ácido 8,6-aminopireno-1,3,6-trisulfónico) permite detectar los azúcares a niveles femtomolar. Diseñados para la separación de biomoléculas hidrofilicas en modo HILIC, las columnas Thermo Scientific™ Accucore™ 150 Amida son una excelente opción para las separaciones de glicanos. Estas columnas de tecnología de núcleo sólido “Core Enhanced Technology™” proporcionan separaciones rápidas y de alta resolución de biomoléculas, sin el inconveniente de las elevadas contrapresiones generadas por columnas tradicionales con partículas de menores de 2 µm. Aquí, la columna Accucore 150 Amida HILIC (2.1 × 150 mm) demostró una gran reproducibilidad inter e intra-columna, así como una excelente vida útil durante el análisis de N-glicanos provenientes de glico-proteínas. Además, se obtuvo una exactitud y precisión excelentes para la cuantificación relativa de N-glicanos de IgG humano, lo que es crítico para el control de calidad y la gestión de riesgos en la fabricación de productos biofarmacéuticos.
Experimental
Consumibles y aparatos
Productos químicos
- Agua desionizada, resistividad de 18,2 MΩ∙cm.
- Acetonitrilo Fisher Scientific™ Optima™ (A955-4)
- Formiato de amonio (99,99% de pureza)
Estándares
- Thermo Fisher Scientific proporcionó amablemente la fetuina N-glicano marcada con 2-AB y la maltotriosa marcada con APT.
- N-glucano IgG humano marcado 2-AB
- Los N-glicanos NIST de mAb etiquetados APT se prepararon con un kit de preparación de muestras de N-glicanos recientemente desarrollado
Equipamiento
Sistema UHPLC Vanquish Horizon:
- Sastema Base Vanquish Horizon (P/N VH-S01-A)
- Bomba binaria H (P/N VH-P10-A)
- Compartimiento de Columnas H (P/N VH-C10-A)
- Automuestreador HT (P/N VH-A10-A) con loop de 25 μL
- Detector de Fluorescencia F (P/N VF-D50-A)
Condiciones de corrida
Columna: Accucore 150 Amida HILIC 2.1 × 150 mm, 2.6 µm (P/N 16726-152130)
Fase Móvil A: ACN 100%
Fase Móvil B: Formiato de Amonio 100 mM, pH 4.4
Flujo de trabajo: 0.45 mL/min
Temperatura de columna: 50 °C
Volumen de muestra: 1–10 µL
Gradiente de fase móvil: ver tabla 1
Long. de onda para glicanos fluorescentes con 2-AB
Ex: 320 nm/ Em: 420 nm
Long. de onda para glicanos marcados con APTS
Ex: 455 nm; Em: 500 nm
Software para adquisición y procesamiento de datos: Thermo Scientific™ Chromeleon™ Chromatography Data System (CDS) 7.2.5
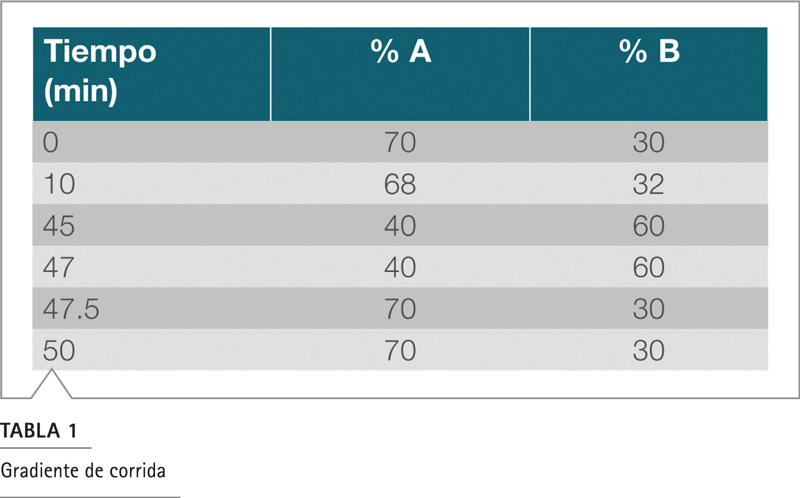
Tabla 1. Gradiente de corrida
Resultados y discusión
Columna prueba de reproducibilidad lote a lote
La reproducibilidad de la columna es un requisito esencial y crítico en la cromatografía. En este estudio, se evaluaron tres lotes aleatorios de columnas Accucore 150 Amida HILIC mediante la cuantificación de N-glicanos de fetuina marcados con 2-AB (2-aminobenzamida). Se logró un desempeño consistente dentro de cada columna y entre las columnas utilizadas (Figura 1A y 1B).
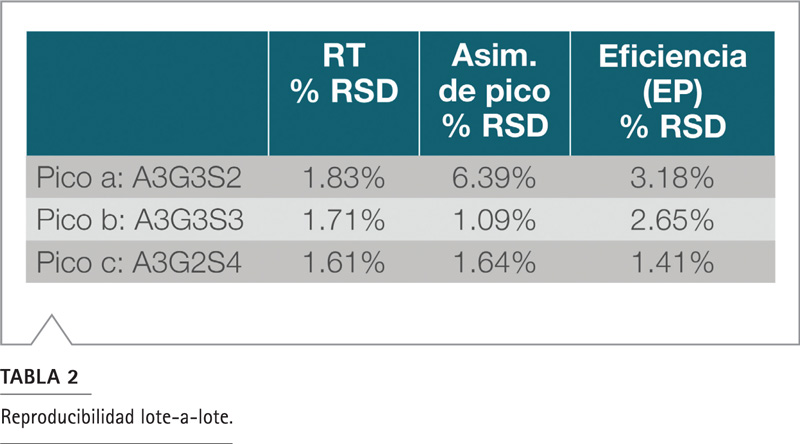
Se calcularon el tiempo de retención, la asimetría de pico y la eficiencia a partir de los cromatogramas obtenidos con los glicanos A3G3S2 marcados con 2-AB (pico A), A3G3S3 (pico B) y A3G2S4 (pico C) de fatuidina, obteniéndose resultados muy consistentes. Como se muestra en la Tabla 2, el % de RSD de lote a lote para el tiempo de retención, la asimetría máxima y la eficiencia son menores que 2%, 6,5% y 3%, respectivamente. La contrapresión también fue monitoreada y fue muy moderada (alrededor de 170 bar, equivalente a 2500 psi). Se observaron presiones muy reproducibles entre columna y columna, con RSD <3% (no se muestran las cifras).
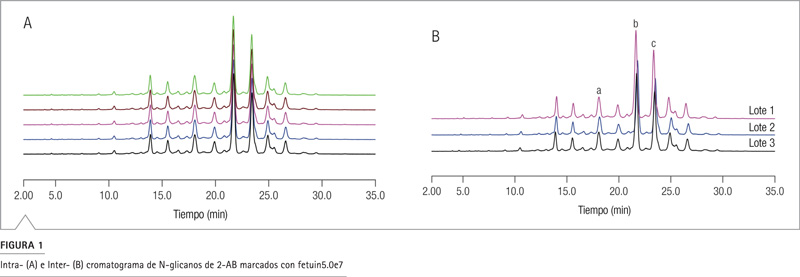
La reproducibilidad total lote a lote fue menor al 7% RSD, con separaciones de glicanos que indican una excelente reproducibilidad de la columna con esta fase HILIC.
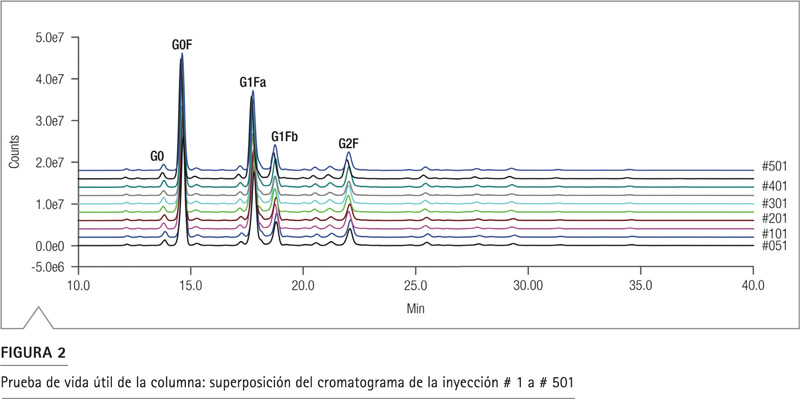
Vida útil de columna – test de robustez
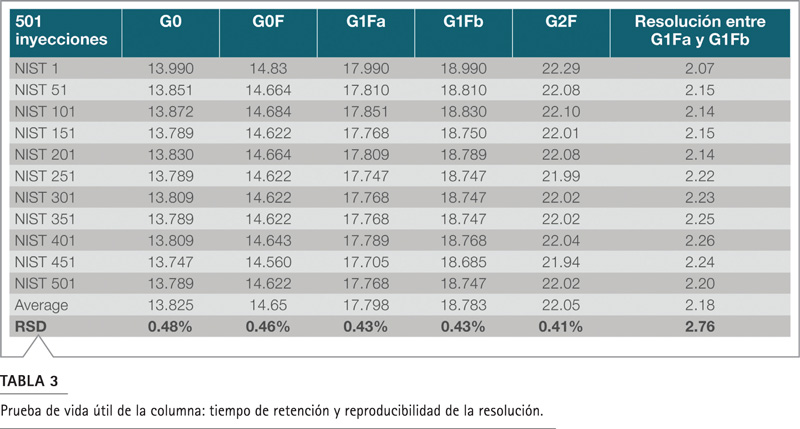
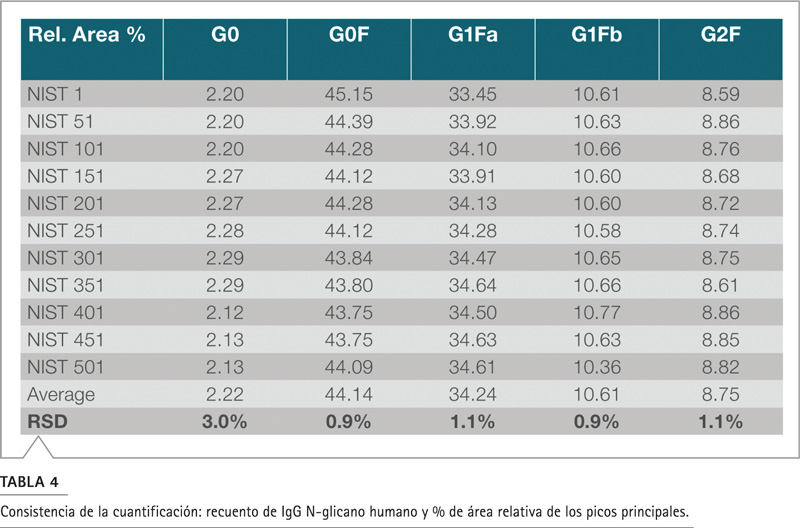
La vida útil de la columna se evaluó realizando 500 corridas cromatográficas continuas, cuyo volumen de inyección fue de 10 µL de proteína glicosilada/maltotriosa marcada con APTS durante nueve días. Las muestras etiquetadas con APTS se dividieron en alícuotas y se almacenaron a -20 °C. Cada día de análisis, se extrajo del congelador una nueva porción de muestra de NIST mAb N-glicano para el análisis. La Figura 2 muestra los cromatogramas de las 500 inyecciones, lo que demuestra una excelente reproducibilidad. Se calculó el tiempo de retención de los principales componentes del glicano en este mAb y se obtuvo un RSD <0.5% (Tabla 3). Los picos de los isómeros G1Fa y G1Fb se separaron eficientemente; la resolución (método USP) se midió de 2.07 a 2.26 con 2.76% RSD. La consistencia de la cuantificación se evaluó con el área relativa para estos cinco componentes principales (Tabla 4). El porcentaje de área relativa para cada componente (rango del 2% al 45%) fue casi idéntico de corrida a corrida, con un RSD en todos los picos principales de 1% con un pico poco abundante de 3%. Este rendimiento duradero, confiable y robusto indica que no hay rastro de degradación de la columna en al menos 500 inyecciones donde se separó la muestra de glicanoproteínas.
Cuantificación de IgG N-glicano humano marcado con 2-AB. A medida que los productos bioterapéuticos glicosilados se mueven a través de la línea de desarrollo, se caracterizan las especies presentes de N-glicanos y el perfil de glucosilación. Como parte de este proceso, los CQA se monitorean de cerca para garantizar que los lotes de producción se mantengan dentro de los criterios de aceptación definidos, y para identificar los parámetros que son críticos, como parte del enfoque de calidad por diseño (QbD, siglas en ingles). El perfil de N-glicosiclación se monitoriza debido a la importancia de estos glicanos en la seguridad y eficacia del tratamiento bioterapéutico.
Un método ideal para el análisis de N-glicanos debe identificar la estructura isomérica y no entregar una imagen real de las cantidades relativas, si no absolutas, de las diversas estructuras en una muestra4. La cuantificación absoluta de una muestra requiere picos bien separados, como el caso de los resultados obtenidos con las últimas columnas HILIC5. La columna de HPLC Accucore 150 Amida HILIC ofrece una excelente separación y cuantificación de N-glicanos IgG humanos marcados con 2-AB.
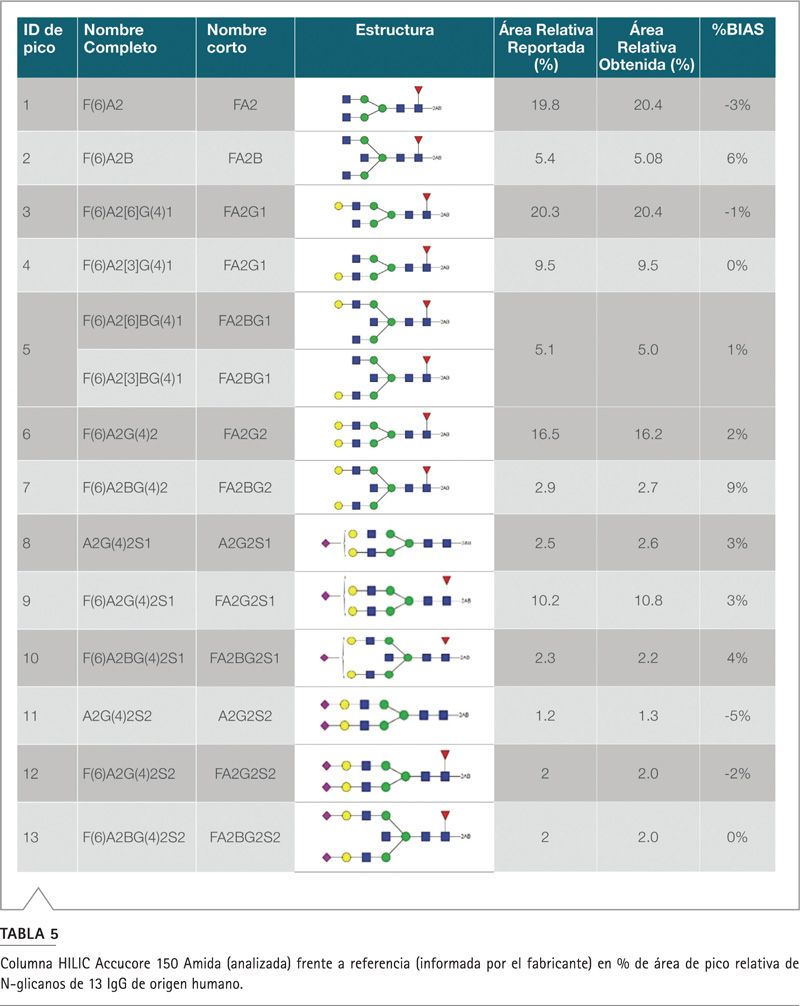
En la Figura 3 se puede ver un cromatograma representativo de N-glicanos de IgG de origen humano, marcados con 10 pmol 2-AB (1 µL de volumen de inyección) separados en la columna Acuccore 150 Amida HILIC y el sistema Vanquish Flex UHPLC. Se detectaron trece glicanos principales bien resueltos en corridas de 22 minutos, con contrapresión moderada <200 bar (3000 psi). Las formas de los picos fueron excelentes para todos los componentes, sin colas ni asimetrías significativas, y un ancho de pico promedio a media altura (PWHH) inferior a 7 segundos. El porcentaje del área del pico relativo de cada componente de glicano se calculó con un promedio de RSD <4% (n=5). Los resultados cuantitativos se compararon con el certificado de análisis de los fabricantes de IgG N-glicano humano marcado con 2-2-AB. Los detalles se enumeran en la Tabla 5.
Con los trece glicanos probados, la variabilidad más alta se obtuvo con el glicano F(6)A2BG(4)2 (pico 7) con un sesgo de + 9%; el más bajo fue F(6)A2[3]G(4)1 (pico 4) a prácticamente RSD = 0%. Un porcentaje promedio absoluto de sesgo de ± 3% indica que los datos obtenidos de nuestra prueba son altamente consistentes con los datos del fabricante. La regresión de Deming (Figura 4) tiene una pendiente de 1.017, lo que demuestra el paralelismo entre los métodos analíticos de fabricación y el análisis usando la columna Acuccore 150 Amida HILIC. Una correlación (R2) de > 0.99 indica una excelente correlación entre los resultados obtenidos en los dos análisis. En general, se obtuvo una gran exactitud y precisión usando la columna Accucore Amida HILIC para la cuantificación de los IgG-N glicanos humanos.
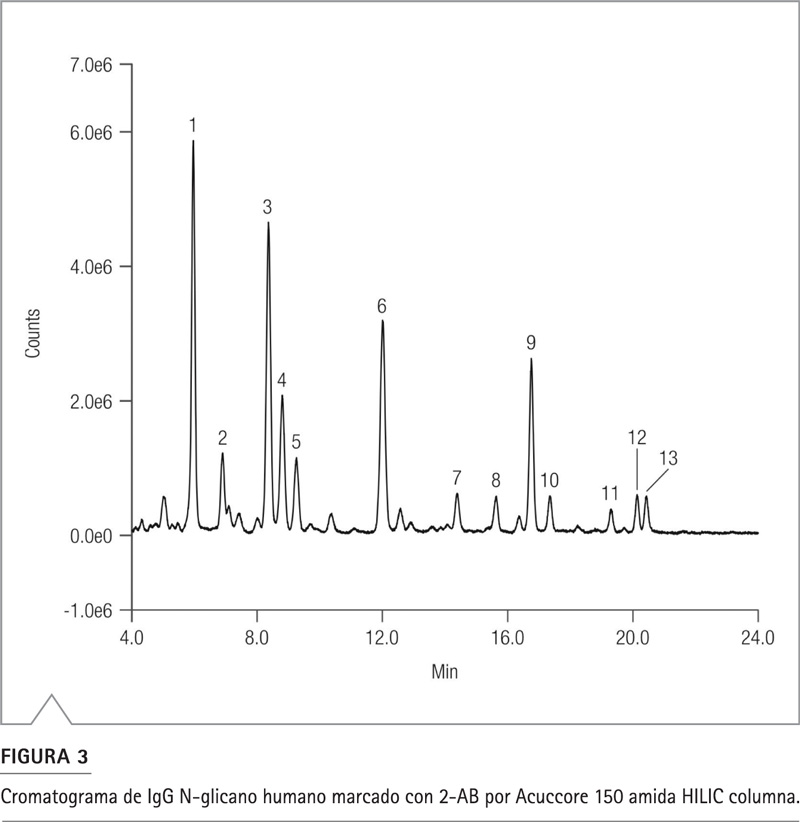 Figura 3. Cromatograma de IgG N-glicano humano marcado con 2-AB por Acuccore 150 amida HILIC columna 5
Figura 3. Cromatograma de IgG N-glicano humano marcado con 2-AB por Acuccore 150 amida HILIC columna 5
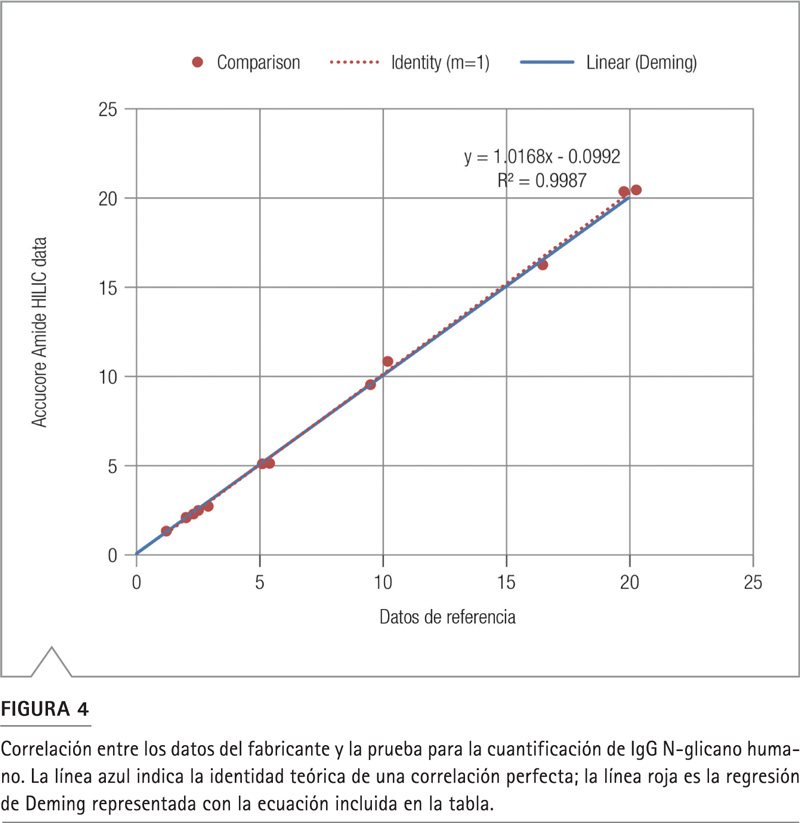
Tabla 5. Columna HILIC Accucore 150 Amida (analizada) frente a referencia (informada por el fabricante) en % de área de pico relativa de N-glicanos de 13 IgG de origen humano.
Conclusiones
La separación y caracterización de los glicanos se ha mantenido como un aspecto importante y desafiante de la caracterización bioterapéutica. Las columnas Accucore 150 HILIC Amida, acopladas a un sistema UHPLC Vanquish formaron una plataforma robusta y una excelente opción para las separaciones de glicanos. Los cromatogramas mostraron una gran forma y resolución máximas, con una presión de columna moderada. Además, la excelente reproducibilidad de la columna lote a lote y la vida útil de la columna demuestran la consistencia y robustez de la columna. Finalmente, la cuantificación exacta y precisa de los N-glicanos de IgG humana ilustra la impresionante correlación con un método de cuantificación completamente validado, que proporciona una referencia robusta y confiable para la validación del control de calidad y el enfoque de la biotecnología calidad por diseño (QbD).
Referencias
- Walsh, G. Nature Biotech. 2010, 28(9), 917–924.
- Fournier, BioPharm. International. 2015, 28(10), 32–37.
- Sanda, ; Pompach, P.; Brnakova, Z.; Wu, J.; Makambi, K.; Goldman, R. Mol. Cell. Proteomics 2013, 12, 1294–1305.
- Grünwald-Gruber, ; Thader, A.; Maresch, D.; Dalik, T.; Altmann, F. Anal. Bioanal. Chem. 2017, 409(10), 2519–2530.
- Ahn, ; Bones, J.; Yu, Y.Q.; Rudd, P.M.; Gilar, M. J. Chromatogr. B. 2010, 878(3-4), 403–408.
- Certificate of analysis for 2AB Labeled IgG N-Glycan Library https://www.ludger.com/ docs/products/cab/cofas/cab-igg-01-b74i-01-cofa.pdf
Reconocimientos
Agradecemos a nuestros colegas de Thermo Fisher Scientific Jim Thayer y Anahita Eckard por su gran ayuda con las muestras de N-glicano. Agradecemos a Jonathan Bones, Investigador Principal, NIBRT por los comentarios que mejoraron enormemente el manuscrito.













