Determinación de la cantidad total de nitrógeno y fósforo en aguas residuales mediante digestión con persulfato alcalino seguida de CI
Brian De Borba, Richard F. Jack, y Jeffrey Rohrer
Thermo Fisher Scientific, Sunnyvale, CA EE. UU.

Introducción
La excesiva utilización de nutrientes durante las últimas décadas ha causado considerables problemas en la calidad del agua y en la salud en todo el mundo. En los Estados Unidos, el impacto de la contaminación por nutrientes se considera uno de los problemas ambientales más generalizados, costosos y complejos del siglo XXI.1 La contaminación por nutrientes causa el crecimiento excesivo de algas, es decir, su afloramiento a lo largo de extensos cuerpos de agua, lo que provoca un fuerte impacto en el medio ambiente, la salud humana y la economía. El afloramiento de algas consume una gran cantidad de oxígeno, lo que priva a los peces, moluscos, y otros organismos acuáticos del oxígeno necesario para sobrevivir.
Además, las algas pueden ejercer un efecto negativo sobre la salud humana al emitir toxinas que pueden causar dolor de estómago, erupciones cutáneas y otras afecciones más serias. Se estima que la industria del turismo estadounidense pierde aproximadamente 1.000 millones de dólares al año debido a la disminución de la actividad pesquera y recreacional causada por las algas.2
Existen alrededor de 14.000 listas de cuerpos de agua “impedidos” relacionados con nutrientes en 49 estados, que incluyen 2,5 millones de acres de lagos y reservorios y 80.000 millas de ríos y arroyos. Aproximadamente el 50% de los arroyos del país contienen niveles medios y altos de nitrógeno y fósforo. Alrededor del 80% de las vías navegables litorales evaluadas en los EE. UU. están siendo afectadas por la eutrofización.3 El exceso de nutrientes en los cuerpos de agua se debe principalmente a la escorrentía de fertilizantes, al abono animal, a los vertidos de las plantas de tratamiento de aguas servidas, a la escorrentía de aguas de tormenta, y a la quema de combustibles fósiles.2 En la cuenca del río Mississippi, la agricultura es la principal causa del exceso de nutrientes. Alrededor de dos tercios de la carga de nitrógeno y aproximadamente la mitad de la carga de fósforo provienen de la actividad agrícola, que no se encuentra reglamentada por la Ley de Agua Limpia.3
Si bien es posible determinar nitratos y fosfatos inorgánicos directamente en aguas naturales, no resulta suficiente para entender el gran significado ambiental de la proporción de nitrógeno y fósforo orgánico que contribuye a la carga total de nutrientes en los cuerpos de agua. El nitrógeno existe como especie inorgánica y orgánica en el agua. El nitrógeno inorgánico está presente en forma oxidada (es decir, nitrito y nitrato) y en forma reducida (amoníaco/amonio y gas nitrógeno). El nitrógeno orgánico se encuentra presente en distintas formas complejas como aminoácidos, proteínas, ácidos húmicos y urea. Sin embargo, antes de utilizarse como nutriente, el nitrógeno orgánico debe primero convertise en amoníaco.4 El nitrógeno total (NT) representa la suma de todas las formas de nitrógeno en la muestra de agua.
El fósforo existe como ortofosfato inorgánico, polifosfato, y fosfato orgánico.5 Las partículas de fósforo, que se encuentran en suspensión o sedimento, consisten en plantas, animales y fósforo en minerales, y fosfato adsorbido en una superficie mineral de oxihidróxido de hierro.4 El fósforo total (FT) es la medida de todas las formas del fósforo presentes en el agua.
El procedimiento estándar para determinar el NT se basa en la determinación del método Kjeldahl (TKN, por su sigla en inglés) más la suma de nitrito y nitrato. El método TKN convierte el nitrógeno orgánico, como aminoácidos, proteínas y péptidos, en amoníaco.6
Uno de los abordajes más comunes para determinar nitritos y nitratos es la cromatografía iónica (CI) con detección de conductividad suprimida de acuerdo con la descripción de los métodos 300.0 y 300.1 de la Agencia de Protección Ambiental (EPA).7,8 Aunque el método TKN está aprobado por el Sistema Nacional de Eliminación de Descargas de Contaminantes y la Ley de Agua Potable Segura, el mismo posee algunas desventajas: 1) Presenta peligros ambientales y de seguridad, dado que emplea reactivos tóxicos (mercurio) a altas temperaturas. 2) Las aguas con altos niveles de nitratos interfieren con el método TKN, generando un sesgo negativo. 3) No se miden los nitratos. 4) Debido a que el TKN no brinda un verdadero valor de NT, se requiere una técnica analítica adicional para alcanzar un valor NT certero.
La digestión con persulfato alcalino constituye el método alternativo para determinar NT y FT. Este es un método robusto y seguro para el medio ambiente, que proporciona una alternativa a la digestión Kjeldahl para determinar el nitrógeno y el fósforo en agua. La edición 22° de los Métodos Estándar para el Análisis del Agua y Aguas Residuales de la American Public Health Association describe un protocolo para determinar NT mediante la digestión con persulfato alcalino, pero el método excluye la determinación de FT.9 A lo largo de 12 meses, el Servicio Geológico de los Estados Unidos (USGS) realizó un estudio a gran escala de amplia diversidad geográfica para determinar nitrógeno Kjeldahl y fósforo Kjeldahl en 2100 muestras de aguas superficiales y subterráneas. Las muestras se analizaron por separado para determinar NT y FT, utilizando la digestión con persulfato alcalino seguida de detección colorimétrica mediante análisis de flujo continuo10. El USGS concluyó que la técnica de digestión con persulfato alcalino es más sensible, precisa, y emplea menos reactivos tóxicos que el método de digestión Kjeldahl.
La cromatografía iónica (CI) es una técnica sólida que se emplea para determinar aniones inorgánicos en muestras ambientales, y ha sido especificada en varios métodos estándar y regulatorios.7,8 La aplicación de CI para la determinación posterior a la digestión con persulfato alcalino se ha concentrado en NT únicamente.11–14 Por lo general, se excluye la determinación de FT mediante CI posterior a la digestión con persulfato debido a la elevada concentración de sulfato producida después de la descomposición del persulfato, dado que puede interferir con la determinación del fosfato.15 Para superar este desafío, algunos autores han empleado peróxido de hidrógeno como alternativa al persulfato como reactivo oxidante, o técnicas con intercambio de columnas después de la digestión con persulfato alcalino.16–18 Sin embargo, los avances significativos en las fases estacionarias de la CI han permitido la determinación simultánea y directa de NT y FT después de la digestion con persulfato alcalino.19
En la actualidad, no existe un método de CI validado para la determinación simultánea de NT y FT posterior a la digestión con persulfato alcalino. La CI ofrece varias ventajas para este tipo de análisis como simplicidad, límites de detección relativamente bajos, y mínima interferencia de la matriz de digestión cuando se utilizan columnas de intercambio aniónico de mayor capacidad. Además, es posible utilizar un eluyente de hidróxido generado electrolíticamente que solo requiere una fuente de agua desionizada, lo que simplifica aún más el método y mejora la calidad de transferencia entre laboratorios.
Este estudio demuestra la determinación simultánea de NT y FT utilizando la columna analítica de alta capacidad, selectiva de hidróxido, Dionex™ IonPac™ AS19 de Thermo Scientific™ con detección de conductividad suprimida posterior a la digestión con persulfato alcalino. La técnica de digestión aquí descripta se extrae del USGS, que emplea concentraciones equimolares de iones de hidróxido y persulfato para arrojar muestras con un pH >12 después de una dilución 1:2. 10 De acuerdo con las condiciones alcalinas iniciales, el nitrógeno de la muestra se oxida y se transforma en nitrato. A medida que se realiza la digestión a altas temperaturas (120 °C), los iones de bisulfato se neutralizan a partir de la descomposición térmica del persulfato, y luego acidifican la mezcla reactiva mediante la siguiente reacción química:
S2O82− + H2O ——–2 HSO4− + ½ O2
Tras la descomposición del persulfato, la mezcla de digestión se acerca a un pH de 2 y, bajo estas condiciones, el fósforo disuelto se hidroliza a ortofosfato.
Objetivo
Demostrar la determinación simultánea de NT y FT en aguas ambientales mediante CI después de la digestión con persulfato alcalino como alternativa a TKN.
Equipamiento e insumos
- Sistema Thermo Scientific Dionex ICS-2100 Reagent-Free™ IC (RFIC™),* compuesto por:
- – Bomba isocrática única
- – Desgasificador
- – Calentador de columna
- – Detector de conductividad
- – Generador de eluyente
- Thermo Scientific Dionex AS-AP Autosampler
- Cartucho generador del eluyente de hidróxido de potasio (KOH) Thermo Scientific Dionex EGC III (P/N 074532)
- Columna trampa de aniones con regeneración continua Thermo Scientific Dionex CR-ATC (P/N 060477)
- Supresor aniónico electrolíticamente regenerado Thermo Scientific™ Dionex™ AERS™ 500 (P/N 082541)
- Software Thermo Scientific™ Dionex™ Chromeleon™ Chromatography Data System, versión 7.2
- Helio o nitrógeno, grado 4.5 (99,995%) o superior (Praxair)
* Se puede utilizar cualquier sistema de CI Thermo Scientific Dionex capaz de generar eluyente para esta aplicación.
- Kit de viales, 10 ml, poliestireno con tapa y septum azul 3 (P/N 074228)
- Termoreactor Thermo Scientific™ Orion™ AQUAfast™ COD165 (P/N COD165)
- Tubos de vidrio de borosilicato desechables FISHERBRAND™ con cuello a rosca, base redondeada, punto de marcado, o.d. × L: 16 × 125 mm (Fisher Scientific P/N 14-959-35A)
- Tapas a rosca FISHERBRAND para tubos de vidrio desechables, fenólico, 15 mm-415 (Fisher Scientific P/N 14-959-36A)
Reactivos y patrones
- Agua desionizada, grado reactivo tipo I, resistencia 18 MΩ-cm o superior
- Solución de hidróxido de sodio (NaOH), 50% w/w (Fisher Scientific P/N SS254-1)
- Peroxodisulfato de potasio (persulfato de potasio), ≥99% (Fluka P/N 60487, Sigma-Aldrich®)
- Nitrito de sodio, certificado ACS, ≥97% (Fisher Scientific P/N S347-250)
- Nitrato de sodio, certificado ACS, ≥99% (Fisher Scientific P/N S343-500)
- Fosfato de potasio monobásico (KH2PO4), certificado ACS, ≥99% (Fisher Scientific P/N P285-500)
- Glicina (C2H5NO2), 98,5 a 101% (Fisher Scientific P/N BP381)
- Glicerofosfato, sal disódica, pentahidratado (C3H7O6Na2 · 5H2O, Fisher Scientific
P/N ICN10291425)
- Urea (CH4N2O), certificado ACS, 99% (Fisher Scientific P/N AC42458)
- Ácido nicotínico (Niacina, C6H5NO2), 99,5% (Fisher Scientific P/N AC12829)
- α-D-Glucosa-1-fosfato sal dipotásica dihidrato (C6H11O9PK2 · 2H2O, Fisher Scientific P/N ICN19467325)
- Cloruro de amonio (NH4Cl), certificado ACS, ≥99,5% (Fisher Scientific P/N A661)
- Ácido fítico, sal dodecasódica (C6H18O24P6 · 12Na, Fisher Scientific P/N 50-121-7886)
- D-(+)-glucosa monohidrato (C6H12O6 · H2O), 99% (Fisher Scientific P/N AAA1109036)
- Adenosina 5’-trifosfato (ATP), sal disódica hidratada (C10H14N5Na2O13P3 · xH2O), 98% (Fisher Scientific P/N AC10280-0100)
Muestras
Se obtuvieron seis muestras de aguas residuales (influentes y efluentes) de dos plantas de tratamiento de la Bahía de San Francisco en California.
Preparación de soluciones y reactivos
Soluciones madre para patrones de calibración
Solución madre de nitrato-N 1000 mg/L
Prepare 1000 mg/L de nitrato como nitrógeno, disolviendo 0,607 g de nitrato sódico en 80 ml de agua desionizada en un matraz aforado de 100 ml. Llene con agua desionizada hasta la marca, coloque la tapa y mezcle completamente mediante inversión manual. Transfiera la solución a un frasco de polipropileno, en donde permanecerá estable durante 6 meses a 4 °C.
Solución madre de nitrito-N 1000 mg/L
Prepare 1000 mg/L de nitrito como nitrógeno, disolviendo 0,492 g de nitrito sódico en 80 ml de agua desionizada en un matraz aforado de 100 ml. Llene con agua desionizada hasta la marca, coloque la tapa y mezcle completamente mediante inversión manual. Transfiera la solución a un frasco de polipropileno, en donde permanecerá estable durante 1 mes a 4 °C.
Solución madre de fosfato-P 1000 mg/L
Prepare 1000 mg/L de fosfato como fósforo, disolviendo 0,439 g de fosfato de potasio monobásico en 80 ml de agua desionizada en un matraz aforado de 100 ml. Llene con agua desionizada hasta la marca, coloque la tapa y mezcle completamente mediante inversión manual. Transfiera la solución a un frasco de polipropileno, en donde permanecerá estable durante 1 mes a 4 °C.
Solución mixta para calibración
Prepare una solución madre mixta para calibración que contega 1 mg/L cada una de nitrito-N, nitrato-N, y fosfato-P, colocando 0,25 ml de cada una de las soluciones madre de 1000 mg/L en un frasco de polietileno (HDPE) de alta densidad de 250 ml. Diluya a 250 g con agua desionizada. Prepare una solución nueva cada vez que se preparen las soluciones de calibración.
Soluciones madre para verificación de digestión
Solución madre de glicina-N (1000 mg/L)
Prepare 1000 mg/L de glicina como nitrógeno, disolviendo 0,536 g de glicina en 80 ml de agua desionizada en un matraz aforado de 100 ml. Llene con agua desionizada hasta la marca, coloque la tapa y mezcle completamente mediante inversión manual. Transfiera la solución a un frasco de polipropileno y almacene a 4 °C.
Solución madre de urea-N (1000 mg/L)
Prepare 1000 mg/L de urea como nitrógeno, disolviendo 0,214 g de urea en 80 ml de agua desionizada en un matraz aforado de 100 ml. Llene con agua desionizada hasta la marca, coloque la tapa y mezcle completamente mediante inversión manual. Transfiera la solución a un frasco de polipropileno y almacene a 4 °C.
Solución madre de ácido nicotínico-N (1000 mg/L)
Prepare 1000 mg/L de ácido nicotínico como nitrógeno, disolviendo 0,879 g de ácido nicotínico en 80 ml de agua desionizada en un matraz aforado de 100 ml. Llene con agua desionizada hasta la marca, coloque la tapa y mezcle completamente mediante inversión manual. Transfiera la solución a un frasco de polipropileno y almacene a 4 °C.
Solución madre de cloruro de amonio-N (1000 mg/L)
Prepare 1000 mg/L de NH4CI como nitrógeno, disolviendo 0,382 g de NH4Cl en 80 ml de agua desionizada en un matraz aforado de 100 ml. Llene con agua desionizada hasta la marca, coloque la tapa y mezcle completamente mediante inversión manual. Transfiera la solución a un frasco de polipropileno y almacene a 4 °C.
Solución madre de ATP-P (1000 mg/L)
Prepare 1000 mg/L de ATP como fósforo, disolviendo 0,593 g de ATP en 80 ml de agua desionizada en un matraz aforado de 100 ml. Llene con agua desionizada hasta la marca, coloque la tapa y mezcle completamente mediante inversión manual. Ajuste la concentración final de acuerdo con el contenido de agua para el lote específico del reactivo ATP. Transfiera la solución a un frasco de polipropileno y almacene a 4 °C.
Solución madre de glucosa-1-fosfato-P (1000 mg/L)
Prepare 1000 mg/L de glucosa-1-fosfato (G1P) como fósforo, disolviendo 1,202 g de sal dipotásica G1P en 80 ml de agua desionizada en un matraz aforado de 100 ml. Llene con agua desionizada hasta la marca, coloque la tapa y mezcle completamente mediante inversión manual. Transfiera la solución a un frasco de polipropileno y almacene a 4 °C.
Solución madre de ácido fítico-P (1000 mg/L)
Prepare 1000 mg/L de ácido fítico como fósforo, disolviendo 0,579 g de ácido fítico sal dodecasódica en 80 ml de agua desionizada en un matraz aforado de 100 ml. Llene con agua desionizada hasta la marca, coloque la tapa y mezcle completamente mediante inversión manual. Ajuste la concentración final de acuerdo con el contenido de agua para el lote específico del reactivo de ácido fítico. Transfiera la solución a un frasco de polipropileno y almacene a 4 °C.
Solución madre de glucosa (1250 mg/L)
Pese 1.564 g de D-(+)-glucosa monohidrato en un matraz aforado de 500 ml. Llene con agua desionizada hasta la marca, coloque la tapa y mezcle completamente mediante inversión manual. Transfiera la solución a un frasco de polipropileno, en donde permanecerá estable durante 6 meses a 4 °C.
Solución madre de glicerofosfato (1000 mg/L)
Pese 0,988 g de glicerofosfato en un matraz aforado de 100 ml. Llene con agua desionizada hasta la marca, coloque la tapa y mezcle completamente mediante inversión manual. Transfiera la solución a un frasco de polipropileno, en donde permanecerá estable durante 6 meses a 4 °C.
Solución mixta para verificación de digestión (1.5 mg/l N, 1.6 mg/l P, 50 mg/l C)
Coloque 0,375 ml de solución madre de glicina, 0,4 ml de solución madre de glicerofosfato, y 10 ml de solución madre de glucosa en un matraz aforado de 250 ml. Llene hasta la marca con agua desionizada, coloque la tapa y mezcle completamente mediante inversión manual. Transfiera la solución a un frasco de polipropileno, donde permanecerá estable durante 6 meses a 4 °C. Utilice esta solución como patrón de verificación permanente de digestión e incorpórela a cada lote de análisis de muestra.
Soluciones de patrón de calibración de trabajo
Prepare soluciones de calibración a 2,5, 5, 10, 25, 50, 100, 200, y 300 μg/L para nitrito-N, nitrato-N, y fosfato-P agregando los volumenes adecuados de la solución madre mixta de calibración. Prepare las concentraciones de 2,5 a 25 μg/l en un frasco HDPE de 250 ml y las concentraciones entre 50 y 300 μg/l en un frasco HDPE de 100 ml.
Reactivos para digestión
Solución de hidróxido sódico de 1,5 m
Coloque ~80 ml de agua desionizada, desgasificada y filtrada en un matraz aforado de 100 ml. Agregue 7,7 ml (11,78 g) de NaOH 50% y mezcle. Llene con agua desionizada hasta la marca, coloque la tapa y mezcle completamente mediante inversión manual. Transfiera la solución a un frasco de polipropileno y almacene a 4 °C.
Reactivo para digestión con persulfato alcalino
Coloque 80 ml de agua desionizada en un matraz aforado de 100 ml. Agregue 10 ml de solución madre de NaOH (1,5 M) seguida de 4 g de persulfato potásico. Tape y agite por sonicación durante 10 minutos. Llene con agua desionizada hasta la marca, coloque la tapa y mezcle completamente mediante inversión manual. No caliente. Prepare una solución fresca a diario.
Preparación de la muestra
Prepare la solución de digestión con persulfato alcalino en una relación 2:1, añadiendo 2 ml de reactivo de digestión con persulfato alcalino a 4 ml de muestra en un tubo de vidrio para digestión. Tape el tubo de digestión y colóquelo en una placa de calentamiento a 120 °C durante 60 min. Una vez finalizada la digestión, deje que el tubo se enfríe hasta llegar a temperatura ambiente. Diluya la solución a un mínimo de 1:10 (dilución total 1:15), filtre, y luego inyéctela en el sistema de CI. Algunas muestras pueden requerir una dilución total de hasta 150.
Cada lote de muestra debe incluir un blanco de agua y la solución mixta para verificación de digestión. Prepare los blancos (4 ml de agua desionizada en lugar de 4 ml de muestra) del mismo modo a fin de determinar la cantidad de nitrato-N en el reactivo de persulfato. Se debe incorporar la solución mixta para verificación de digestión a fin de asegurar que el reactivo funcione correctamente.
Resultados y consideraciones
Selección de la columna
Previo al análisis de CI, se utilizó la digestión con persulfato alcalino para convertir todas las formas de nitrógeno y fósforo a nitrato y ortofosfato, respectivamente. Durante la reacción de digestión, la descomposición térmica del persulfato produce iones de bisulfato. Por lo tanto, la alta concentración de sulfato que permanece en la muestra final puede sobrecargar la mayoría de las columnas de intercambio aniónico. Aunque la dilución de la muestra puede contribuir a minimizar este efecto, las bajas concentraciones de nitrógeno y fósforo presentes en la mayoría de las muestras impiden una dilución suficiente para eliminar la interferencia potencial del sulfato.
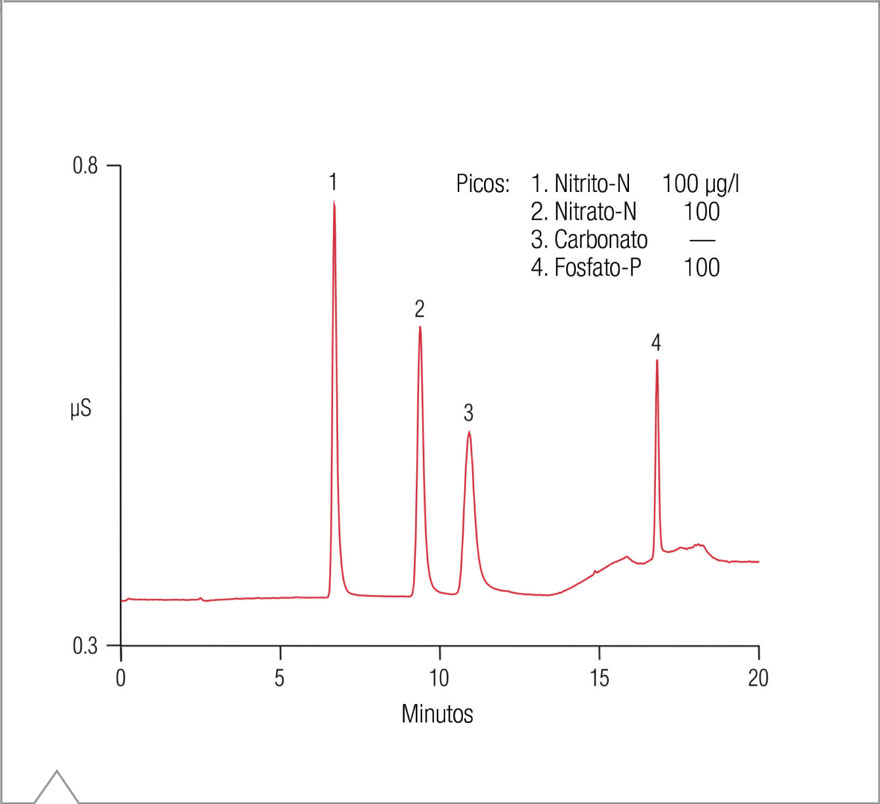
El abordaje alternativo consiste en utilizar una columna de intercambio aniónico de gran capacidad que pueda resolver el nitrato-N y el fosfato-P de las altas concentraciones de sulfato y otras interferencias potenciales de las muestras de aguas residuales. En este estudio, la columna de alta capacidad Dionex IonPac AS19 logró separar el nitrato-N y el fosfato-P en menos de 20 minutos y eliminó la interferencia potencial de dichos componentes, principalmente con el sulfato en las digestiones con persulfato alcalino. La Figura 1 muestra la separación estándar de nitrito-N, nitrato-N y fosfato-P en la columna selectiva de hidróxido Dionex IonPac AS19, utilizando las condiciones optimizadas aquí descriptas.
Interferencias potenciales
El cloruro, el clorato, el carbonato y el sulfato pueden interferir potencialmente con la determinación de bajas concentraciones de nitrato y fosfato mediante CI después de la digestión con persulfato alcalino. Debido a que la mayoría de las muestras de aguas residuales contienen concentraciones moderadas y altas de cloruro, el clorato generado por la oxidación del cloruro puede causar interferencia potencial hacia el final de la reacción, cuando el pH de la digestión se vuelve altamente acídico.
En un estudio anterior de Halstead et al.14, los autores revelaron que la cantidad de clorato producido durante la digestión se vincula con la relación inicial de persulfato:hidróxido sódico. En una relación de persulfato a hidróxido de 2:1, casi el 50% del cloruro presente en la muestra se oxidó a clorato, comparado con alrededor del 20% cuando la relación fue de 1:1. En ambos escenarios, el pH final de la reacción de digestión fue 2, que resulta crítico para convertir fracciones de fósforo inorgánico y orgánico a fosfato. Sin embargo, cuando la relación de persulfato a hidróxido fue 2:1, se observó una mínima o ninguna oxidación de cloruro a clorato. Lamentablemente, estas condiciones iniciales produjeron un pH final de 11, impidiendo la conversión del fósforo a fosfato.
A fin de resolver la potencial interferencia del clorato, se debe utilizar una columna de intercambio aniónico de gran capacidad con buena resolución de clorato a nitrato. La columna Dionex IonPac AS19 proporciona gran capacidad, al tiempo que es posible utilizar hidróxido en condiciones de gradiente para optimizar la separación y alcanzar una buena resolución entre el clorato y el nitrato. La Figura 2 muestra la separación de 10 μg/l de nitrato-N y fosfato-P, respectivamente, en una matriz de muestra sintética de laboratorio que contiene 250 mg/l de cloruro y de sulfato, 50 mg/l de clorato, y 150 mg/l de carbonato. Aunque esta matriz representa un caso extremo en relación con las muestras encontradas en este estudio, la separación demuestra que se resuelven las interferencias potenciales del nitrato y el fosfato.
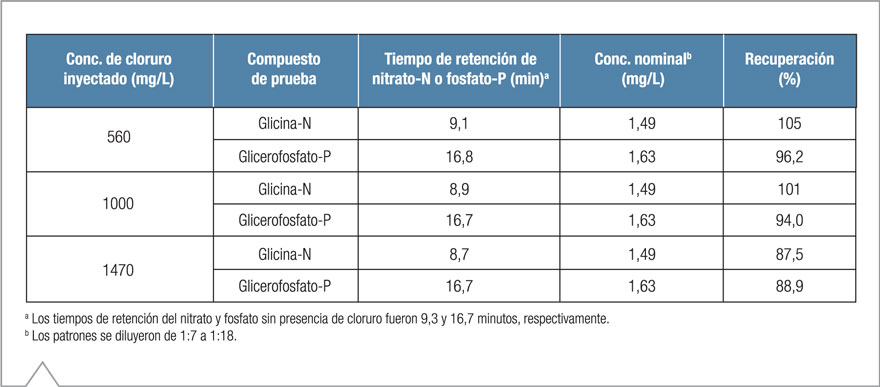
Además de la interferencia potencial del clorato, las altas concentraciones de cloruro en las muestras también pueden resultar problemáticas para determinar bajas concentraciones de nitratos. Para evaluar la influencia del cloruro en la determinación del nitrato-N y fosfato-P, se preparó un patrón compuesto por concentraciones conocidas de glicina-N y glicerofosfato-P a fin de obtener las concentraciones de cloruro finales entre ~500 y 1500 mg/L después de la digestión con persulfato alcalino.
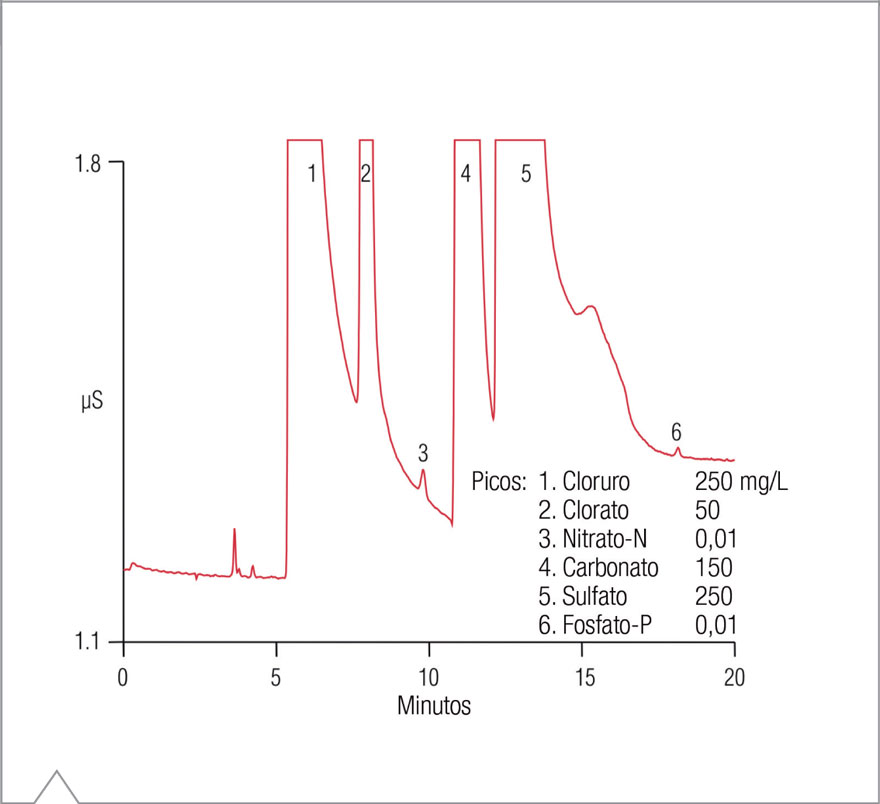
Figura 2. Separación de bajas concentraciones de nitrato-N y fosfato-P en una matriz de muestra sintética de laboratorio.
La Tabla 1 resume los resultados de este estudio. Como se observa, la concentración de cloruro de ≤1000 mg/L no tuvo impacto en la recuperación del nitrato-N y fosfato-P del patrón. Sin embargo, debido a que las crecientes concentraciones de cloruro pueden tener un efecto eluyente en los aniones, se observó una disminución en el tiempo de retención del nitrato. Para concentraciones de cloruro de 560 mg/L y 1000 mg/L, el tiempo de retención del nitrato disminuyó ~2% y 4%, respectivamente.
Cuando la concentración alcanzó aproximadamente 1500 mg/L de cloruro, la recuperación de nitrato-N y fosfato-P disminuyó ~10–15%, mientras que el tiempo de retención del nitrato se redujo 6,5%. La concentración de cloruro no tuvo impacto en el tiempo de retención del fosfato.
Debido a la descomposición del persulfato durante la reacción, el sulfato es el anión primario en las soluciones de digestión con persulfato alcalino que causa interferencia. Las altas concentraciones de sulfato pueden impedir la determinación del fosfato-P. Probablemente esta sea la razón por la que muchos de los estudios anteriores que utilizaron CI excluyeron la determinación del fosfato, evitaron la digestión con persulfato alcalino, o desarrollaron un abordaje más complejo para minimizar dicha interferencia.
Aunque no se determinó la concentración de sulfato en este estudio, un estudio anterior estimó una concentración de ~4500 mg/L después de la reacción de digestión.18 Por lo tanto, es fundamental emplear una columna de intercambio aniónico de alta capacidad que pueda brindar una buena resolución entre el sulfato y el fosfato. A pesar de que el método utilizó una columna de gran capacidad, la alta concentración de sulfato impide la inyección directa de la muestra posterior a la digestión (dilución de 1,5 veces del agregado de la solución de digestión a la muestra).
La dilución de muestra mínima absoluta determinada para este método es 1:8, que aun así permite una buena resolución entre el nitrato y el sulfato y entre el sulfato y el fosfato. Sin embargo, la dilución mínima implementada en este estudio fue 1:15 a fin de minimizar otras interferencias potenciales de la muestra.
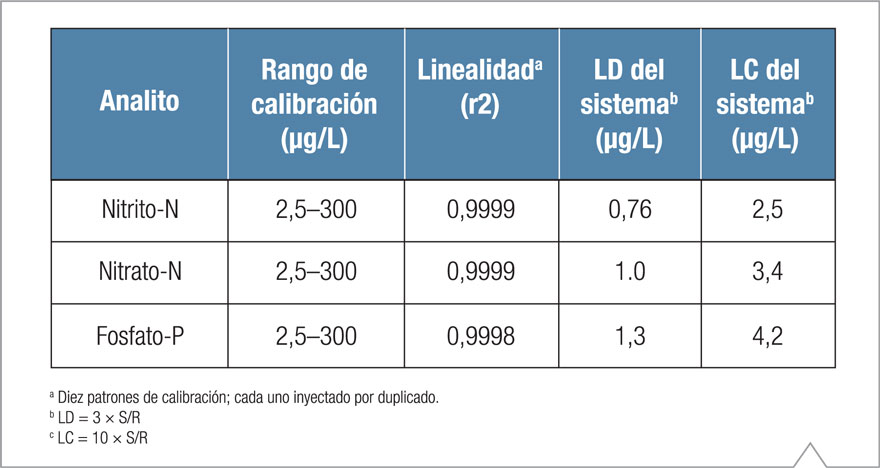
La Tabla 2 resume los datos de calibración. Tabla 2. Linealidad, LD, LC para nitrito-N, nitrato-N, y fosfato-P.
Linealidad, límites de detección y límites de cuantificación.
El desempeño inicial del método se evaluó mediante la determinación de la linealidad, los límites de detección (LD), y los límites de cuantificación (LC) del método. Debido a que el estudio empleó un eluyente de hidróxido generado electrolíticamente, se observó una conductividad de fondo suprimida extremadamente baja de ~0,35 μS a 20 mM KOH (inicio del análisis) con un leve aumento de ~0,39 μS a 50 mM KOH (fin del análisis). Por lo tanto, la baja conductividad de fondo generó un menor ruido basal (~0.5–1 nS), que permitió bajos límites de detección.
En este estudio, el nitrito-N, el nitrato-N y el fosfato-P se calibraron de 2,5 a 300 μg/l, utilizando una curva de calibración de 10 puntos con cada concentración inyectada por duplicado. La curva se generó tabulando el área pico versus la concentración, que produjo un coeficiente de determinaciones (r2) entre 0,9998 y 0,9999.
Se incluyó el nitrito-N en la calibración para determinar la concentración de cualquier nitrito-N presente en las muestras no digeridas. Sin embargo, no se esperaba una cantidad significativa de nitrito-N en las muestras, dado que la mayoría se habría oxidado y convertido a nitrato.
Los LD y LC del sistema para los analitos diana se determinaron en base a 3 veces la relación señal-ruido (S/R) y 10 veces S/R, respectivamente. Los LD calculados para nitrito-N, nitrato-N, y fosfato-P fueron 0,76, 1, y 1,3 μg/L, respectivamente. Los LC para nitrito-N, nitrato-N, y fosfato-P fueron 2,5, 3,4, y 4,2 μg/L, respectivamente. También se estimaron los LD y LC para nitrato-N y fosfato-P en las muestras posteriores a la digestión.
Es fundamental en este estudio utilizar sal de persulfato de bajo nitrógeno, dado que la mayoría de los reactivos pueden presentar variaciones significativas en su contenido de nitrógeno. En cuanto a la sal de persulfato postásico del estudio, la concentración de fondo de nitrato-N varió de 5 a 8 μg/L, mientras que no se detectó fosfato-P. Por lo tanto, el LC estimado para el nitrato-N fue ~58 μg/L. Para el fosfato-P, el LD y LC de la muestra fue ~16 μg/L y 54 μg/L, respectivamente.
Desempeño analítico de los patrones de control de calidad
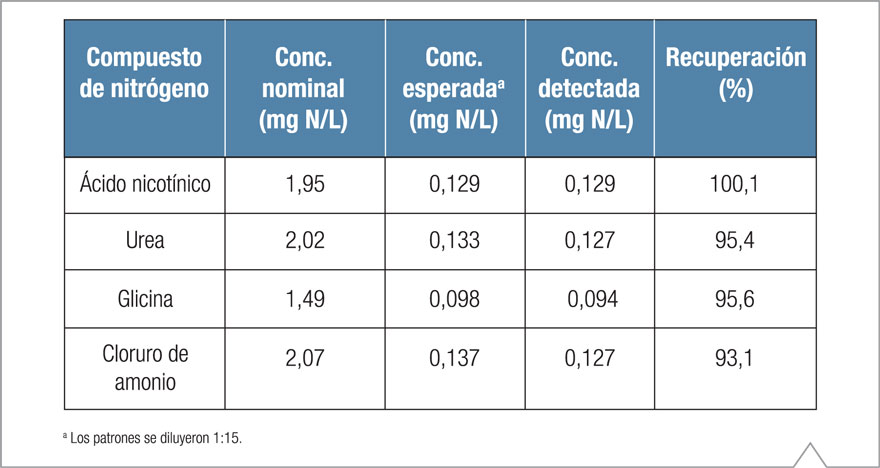
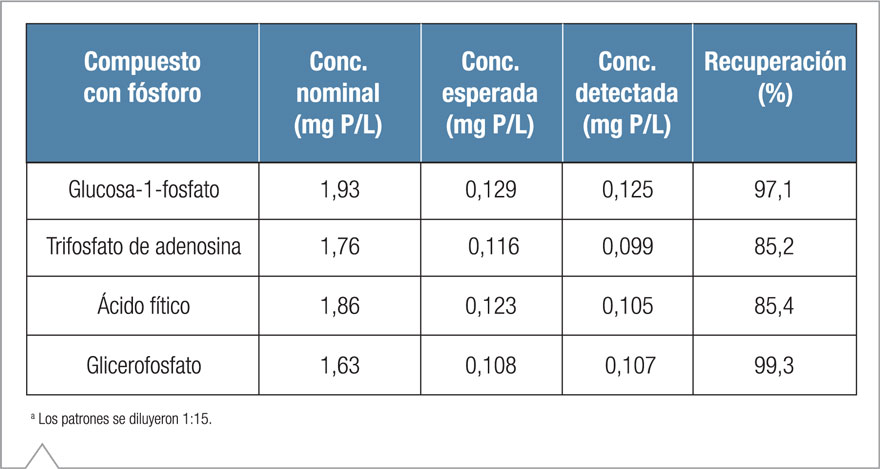
Antes de analizar las muestras de aguas residuales en este estudio, se realizaron experimentos preliminares para establecer el desempeño de la digestión con persulfato alcalino seguida de CI con detección de conductividad suprimida para nitrato-N y fosfato-P. Las Tablas 3 y 4, respectivamente, muestran la recuperación de nitrógeno y fósforo de los compuestos individuales que contenían nitrógeno y fósforo.
La recuperación de nitrógeno para los compuestos evaluados varió del 93 al 100% (Tabla 3), lo que indica una buena conversión a nitrato-N mediante el procedimiento de digestión con persulfato alcalino. Las recuperaciones obtenidas de los compuestos de fósforo fueron menores (Tabla 4), lo que se puede atribuir a la menor pureza de los compuestos de la prueba y a la variabilidad de adsorción de agua durante el almacenamiento de largo plazo. La recuperación de fósforo del trifosfato de adenosina y del ácido fítico fue similar, aunque levemente menor al compararla con los resultados presentados por el USGS, que empleó el mismo procedimiento de digestión con persulfato alcalino.10 La recuperación de fósforo de la glucosa-1-fosfato y del glicerofosfato fue significativamente mejor que aquella obtenida de los compuestos que contenían fósforo, que arrojaron una recuperación de ~97 y 99%, respectivamente.
Se utilizó una solución de glicina-N de 1,5 mg/L, glicerofosfato-P de 1,6 mg/L, y glucosa-C de 50 mg/L como solución para verificación de digestión permanente. El agregado de glucosa a la solución de verificación no tuvo impacto en la cromatografía o en la recuperación de nitrógeno y fósforo. La Figura 3 muestra un cromatograma de la solución para verificación de digestión permanente después de una dilución 1:15.
Análisis de muestras de aguas residuales
Las plantas de tratamiento de aguas residuales de los Estados Unidos procesan aproximadamente 34.000 millones de galones de aguas residuales por día. Dichas aguas contienen nitrógeno y fósforo de desechos humanos, alimentos y detergentes. Después del tratamiento del agua conforme las leyes estaduales y federales, la misma se vierte en los cuerpos de agua de cada lugar, donde puede convertirse en fuente de contaminación de nitrógeno y fósforo.20 Las concentraciones de fosfato han disminuido debido a la reducción en el uso de detergentes de fosfato y la consecuente disminución en la cantidad de fosfatos desechados de las plantas de tratamiento de aguas residuales. La mejoría en el tratamiento de las aguas residuales, que convierte el amoníaco en nitrato, ha logrado reducir las concentraciones de amoníaco pero ha aumentado la concentración de nitrato en los arroyos. Por lo tanto, el nitrógeno total (NT) de las áreas metropolitanas ha mostrado pocos cambios en los últimos 20 años.21
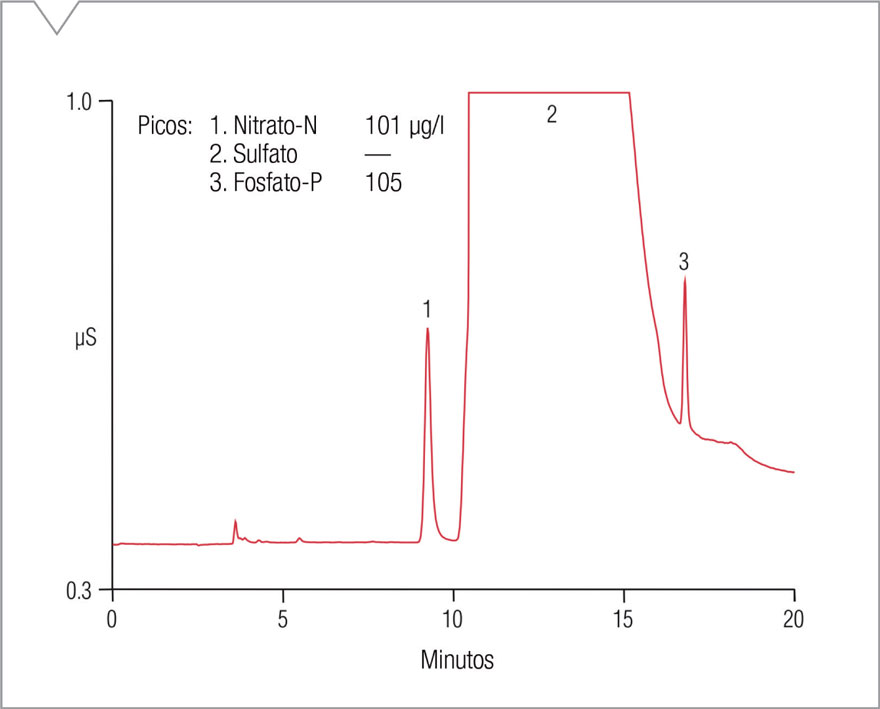
Figura 3. Separación de nitrato-N y fosfato-P después de la digestión con persulfato alcalino de glicina-N, glicerofosfato-P, y glucosa-C.
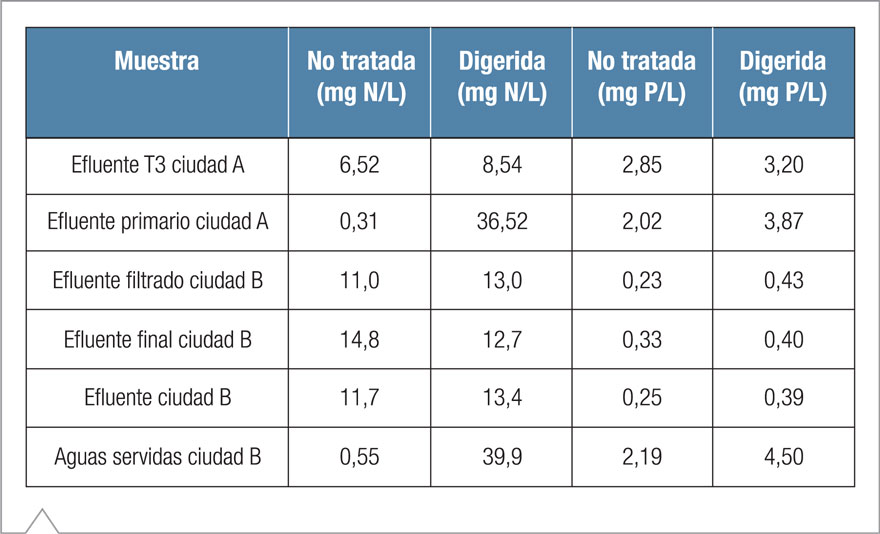
Tabla 5. Resultados de la determinación de nitrógeno y fósforo en muestras de aguas residuales digeridas y no tratadas.
En este estudio, se obtuvieron seis muestras diferentes de aguas residuales de dos plantas de tratamiento de efluentes a fin de evaluar el desempeño del método de digestión con persulfato alcalino y cromatografía iónica (CI). De dichas muestras, solo una se tomó de un arroyo influente (es decir, aguas servidas), mientras que el resto de las muestras provinieron de arroyos efluentes. Previo a su procesamiento mediante digestión con persulfato alcalino, las muestras se diluyeron, filtraron e inyectaron directamente en el sistema de CI sin mayor tratamiento. Por lo tanto, fue posible determinar nitrito-N, nitrato-N y fosfato-P inorgánicos presentes en la muestra. Sin embargo, no se pudo determinar la concentración de amoníaco mediante este proceso. Después de la evaluación inicial de las muestras, las aguas residuales se sometieron a digestión con persulfato alcalino para determinar las concentraciones de NT y FT.
La Tabla 5 resume los resultados del análisis de las muestras de aguas residuales mediante CI antes y después de la digestión con persulfato alcalino. No se detectó nitrito-N en ninguna de las muestras evaluadas, dado que cualquier nitrito-N residual probablemente se transformó en nitrato-N al oxidarse. Las concentraciones de nitrato-N en las muestras no digeridas variaron de ~0,5 a ~15 mg/L. Las concentraciones de fosfato-P en las muestras no digeridas fueron considerablemente menores, con valores que oscilaron entre 0,2 and ~3 mg/L.
Después de realizar las digestiones con persulfato alcalino, no se observó un aumento significativo de las concentraciones de fosfato-P. En total, las concentraciones de FT (como fosfato-P) oscilaron entre 0,4 a 4,5 mg/L. Sin embargo, se observaron aumentos significativos en las concentraciones de NT para las muestras del efluente primario de la ciudad A y de aguas servidas de la ciudad B, lo que probablemente señala altos niveles de amoníaco y/o nitrógeo ligado orgánicamente. La Figura 4 compara la separación de nitrato-N y fosfato-P en muestras de aguas servidas digeridas y no digeridas. Como se observa, se produjo un aumento significativo del nitrato-N, mientras que el fosfato-P aumentó levemente.
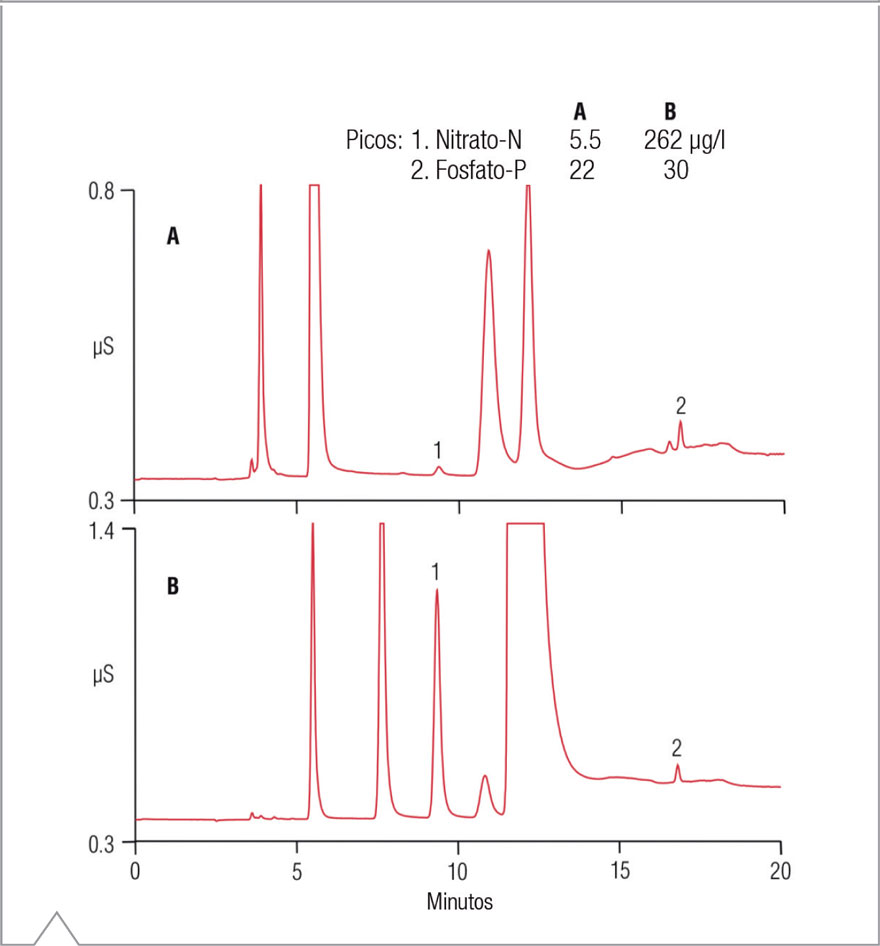
Figura 4. Comparación entre aguas servidas no digeridas (A) y digeridas (B).
A fin de evaluar la reproducibilidad diaria de la digestión con persulfato alcalino, la muestra de efluente primario de la ciudad A se digirió durante cuatro días consecutivos utilizando una solución para digestión fresca todos los días. La concentración promedio de nitrato-N a lo largo de los cuatro días fue 36,4 ± 1,1 mg/L con una desviación estándar relativa (RSD) de 3,1. Para fosfato-P, la concentración promedio fue 3,68 ± 0.14 mg/L con una RSD de 3,9. El tiempo de retención y la desviación estándar relativa del área de picos para nitrato-N mostraron una variación de 0,03 a 0,04 y de 0,11 a 0,13, respectivamente. Para fosfato-P, la variación fue de 0,01 a 0,05 y de 0,58 a 1,14, respectivamente. Para determinar las recuperaciones, se fortificó la misma muestra con concentraciones conocidas de nitrato-N y fosfato-P antes de la digestión. La recuperación promedio a partir de la fortificación fue del 84,5% y 89,5% para nitrato-N y fosfato-P, respectivamente.
Conclusión
La columna polimérica de alta capacidad selectiva para hidróxido Dionex IonPac AS19 resulta efectiva para la determinación simultánea de NT y FT mediante cromatografía iónica (CI) con detección de conductividad suprimida después de la digestión con persulfato alcalino. Es esencial utilizar una columna de alta capacidad para esta aplicación a fin de minimizar las interferencias cromatográficas del cloruro, clorato (mediante oxidación de cloruro), y sulfato. El eluyente de hidróxido generado electrolíticamente produce una conductividad de fondo suprimida significativamente baja que permite límites de detección de μg/L de un solo dígito de nitrato-N y fosfato-P. La recuperación de NT y FT a partir de compuestos de nitrógeno y fósforo con contenido orgánico es comparable a los datos colorimétricos informados por el USGS para compuestos iguales o similares. Estos resultados demuestran que la CI pueden utilizarse como método alternativo sin las desventajas inherentes comúnmente asociadas a los métodos colorimétrios.
Referencias
- An Urgent Call to Action: Report of the State-EPA Nutrient Innovations Task Group, U.S. EPA, Washington, DC [Online] 2009, http://water.epa.gov/ scitech/swguidance/standards/criteria/nutrients/upload/2009_08_27_criteria_nutrient_nitgreport.pdf (accessed June 25, 2014).
- The Facts about Nutrient Pollution, U.S. EPA, Washington, DC [Online] 2012, http://midwestadvocates.org/assets/resources/nutrient_pollution_factsheet.pdf (accessed June 25, 2014).
- Piotrowski, J.; Wagner, K.; Gibson, R. Nitrogen and Phosphorus Pollution and Harmful Algal Blooms in Lakes, EPA Watershed Academy Webcast, January 26, 2011 [Online] http://water.epa.gov/learn/training/wacademy/archives-2011-01-26.cfm (accessed June 25, 2014).
- Atkinson, I.; Heggie, D.; Scanes, P.; Radke, L. Water Column Nutrients. OzCoasts Australian Online Coastal Information [Online] www.ozcoasts.gov.au/indicators/water_column_nutrients.jsp (accessed June 25, 2014).
- Marshall, R. Best Management Practices Guide for Nutrient Management in Effluent Treatment, Technical Report for Forest Products Association of Canada: Ottawa, ON, Canada, April, 2008.
- U.S. EPA Method 351.2: Determination of Total Kjeldahl Nitrogen by Semi-Automated Colorimetry. Cincinnati, Ohio, August 1993.
- U.S. EPA Method 300.0: Determination of Inorganic Anions in Drinking Water by Ion Chromatography. Cincinnati, Ohio, 1993.
- U.S. EPA Method 300.1: Determination of Inorganic Anions in Drinking Water by Ion Chromatography. Cincinnati, Ohio, revised 1997.
- Standard Methods for the Examination of Water and Wastewater, 22nd ed. American Public Health Association, Washington, DC, 2012, pp 4–156.
- Patton, C.J.; Kryskalla, J.R. Methods of Analysis by the U.S. Geological Survey National Water Quality Laboratory—Evaluation of Alkaline Persulfate Digestion as an Alternative to Kjeldahl Digestion for Determination of Total and Dissolved Nitrogen and Phosphorus in Water, U.S. Geological Survey Water-Resources Investigations Report 03–4174, Denver, CO, 2003.
- Karthikeyan, S.; He, J.; Palani, S.; Balasubramanian, R.; Burger, D. Determination of Total Nitrogen in Atmospheric Wet and Dry Deposition Samples. Talanta, 2009, 77 (3), 979–984.
- De Vargas, M.C.; De Medina, H.L.; Villalobos, E.; Gutierrez, E. Determination of Total Nitrogen in Sediments by Using High-Pressure Bombs and Ion Chromatography. Analyst, 1995, 120, 761–763.
- De Medina, H.L.; De Vargas, M.C.; Marin, J.; Pirela, D. Determination of Total Nitrogen in Water Samples by Means of High-Pressure Bombs and Ion Chromatography. J. Chromatogr. A, 1994, 671, 287–293.
- Halstead, J.A.; Edwards, J.; Reginald J.; Soracco , R.J.; Armstrong, R.W. Potential for Chlorate Interference in Ion Chromatographic Determination of Total Nitrogen in Natural Waters Following Alkaline Persulfate Digestion. J. Chromatogr. A, 1999, 857 (1–2) 337–342.
- Ruiz-Calero, V.; Galceran, M.T. Ion Chromatographic Separations of Phosphorus Species: A Review. Talanta, 2005, 66 (2), 376–410.
- Colina, M.; Gardiner, P.H.E. Simultaneous Determination of Total Nitrogen, Phosphorus and Sulphur by Means of Microwave Digestion and Ion Chromatography. J. Chromatogr. A, 1999, 847 (1–2), 285–290.
- Vorob’eva, I.S.; Gurskii, V.S. Determination of the Total Content of N, P, and S in Water Using Ion-Chromatography. Ind. Lab. (Diagn. Mater.), 2000, 66 (8), 505–507.
- Colombini, S.; Polesello, S.; Valsecchi, S. Use of Column-Switching Ion Chromatography for the Simultaneous Determination of Total Nitrogen and Phosphorus after Microwave Assisted Persulphate Digestion. J. Chromatogr. A, 1998, 822 (1), 162–166.
- Pohl. C. Recent Developments in Ion-Exchange Columns for Ion Chromatography. LCGC North Am. 2013, 31 (4), s16–s22.
- The Sources and Solutions: Wastewater, U.S. EPA, Nutrient Pollution, Washington, DC [Online] www2.epa.gov/nutrientpollution/sources-andsolutions-wastewater (accessed June 25, 2014).
- Nutrients from Atmospheric and Urban Sources, Fertilization, and Livestock Wastes Can Contribute to Excessive Algal Growth in Streams, U.S. Geological Survey [Online] http://pubs.usgs.gov/circ/circ1225/pdf/nutrients.pdf (accessed June 25, 2014).