Diferenciación de materias primas biofarmacéuticas mediante espectroscopía Raman compensada espacialmente.

Diferenciación de materias primas biofarmacéuticas mediante espectroscopia Raman compensada espacialmente. Medición de materias primas sin muestreo: directamente a través de los contenedores
Introducción
Uno de los grandes retos del sector consiste en garantizar un suministro continuo de materias primas biofarmacéuticas que cumplan con las normativas establecidas. El aumento en la demanda a nivel mundial ha dado lugar a importantes catástrofes en la industria biofarmacéutica y el sector farmacéutico. En el año 2008, la escasez de cerdos aptos debido a un brote de gripe porcina, junto con un incremento del 100 % en el precio de la heparina en bruto, dio lugar a la contaminación de la heparina por sulfato de condroitina hipersulfatado, que consiguió entrar en la cadena de suministro (1). Como consecuencia del escándalo, los organismos de regulación de todo el mundo recomendaron encarecidamente a los fabricantes de productos biofarmacéuticos perfeccionar los controles que ya existían e implantar soluciones basadas en la tecnología analítica de procesos (PAT) con el objetivo de incrementar el control de los bioprocesos. Entre este tipo de controles, el cribado y las pruebas de identificación de las materias primas a su recepción constituyen uno de los puntos de defensa de primera línea más eficaces a la hora de prevenir la introducción de materias primas que no cumplen con la normativa. Sin embargo, los protocolos de pruebas de identificación que existen en la actualidad y que se basan, a menudo, en la espectroscopia infrarroja por transformada de Fourier (FTIR) o la espectroscopia Raman, no son adecuados para satisfacer las necesidades en cuanto a calidad y a rapidez que exige la producción biofarmacéutica.
Los procesos iniciales en la industria biofarmacéutica suelen funcionar de forma continua. Los tanques de preparación de medios y los reactores pueden llegar a consumir entre 800 y 1.600 kg de medios de crecimiento, carbohidratos, tampones y aminoácidos en un solo ciclo. Todo ello genera una demanda de materias primas capaz de desbordar los procesos de suministro de los almacenes. La apertura de contenedores de materias primas para extraer muestras con fines de identificación y de realización de pruebas de calidad conlleva gran cantidad de tiempo y reduce la capacidad del almacén de satisfacer la demanda de producción.
El objetivo de este estudio era demostrar el uso del instrumento portátil Raman Agilent Vaya para diferenciar correctamente unas materias primas de otras. El instrumento Vaya es capaz de medir los materiales a través del contenedor. Esta capacidad ofrece un ahorro significativo de tiempo en el proceso de recepción y de devolución de las materias primas a su curso para incorporarlas a los procesos iniciales de la industria biofarmacéutica.
Sistema Raman Agilent Vaya para pruebas de identificación
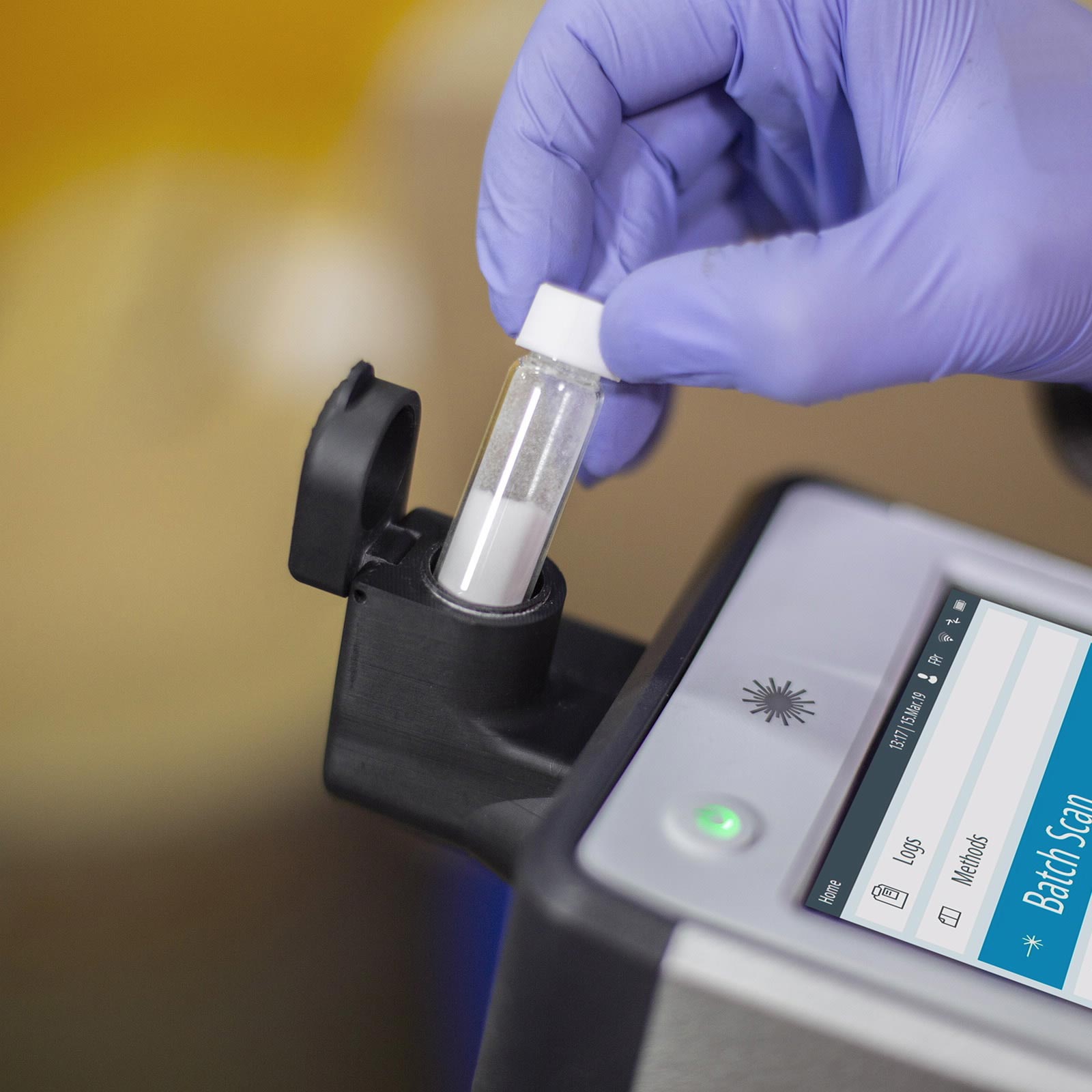
Figura 1. Uso del espectrómetro portátil de Raman Agilent Vaya para medir los materiales que se encuentran en sacos en un almacén de cuarentena.

El espectrómetro portátil de Raman Agilent Vaya (Figura 1) agiliza la verificación de la identificación de las materias primas biofarmacéuticas para productos biológicos. Permite que cualquier persona que no esté especializada en espectroscopia pueda llevar a cabo una prueba de identificación a través de contenedores transparentes y no transparentes en cualquier lugar en el que sea necesario llevar a cabo la identificación. Mediante la espectroscopia Raman compensada espacialmente (SORS), un instrumento Vaya lleva a cabo una prueba de identificación en segundos y proporciona un resultado de PASA/FALLA. Un solo trabajador puede recibir con facilidad las materias primas y devolverlas a su curso para incorporarlas a la producción en cuestión de horas. En consecuencia, dejan de ser necesarias las cabinas de muestreo, la apertura de contenedores, los EPI y los transportes logísticos a la cabina de muestreo y de vuelta.
Espectroscopia Raman compensada espacialmente
La espectroscopia de Raman se basa en la excitación del analito para alcanzar un estado electrónico virtual mediante luz monocromática y el posterior sondeo de los modos de vibración de los enlaces covalentes. La posterior desexcitación suele desplazar la luz monocromática (el láser) hacia arriba o hacia abajo para obtener un espectro Raman con bandas (desplazamientos) específicas de las subestructuras de la molécula.
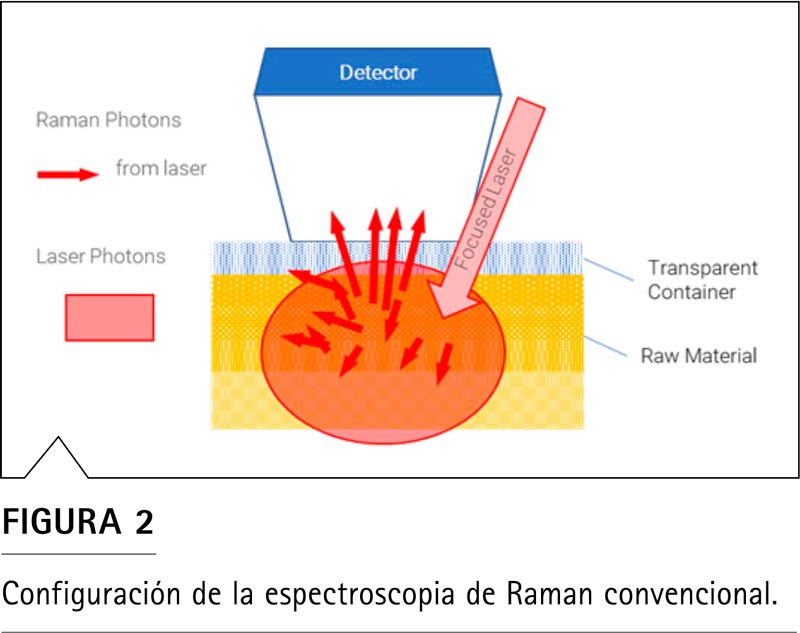
En la espectroscopia de Raman convencional (Figura 2), el análisis a través de los contenedores transparentes es posible mediante el posicionamiento óptico del punto focal del láser y la maximización de la señal Raman en una compensación de la apertura del espectrómetro a fin de excitar principalmente el contenido que se encuentra dentro del recipiente en lugar del propio recipiente.
La espectroscopia Raman compensada espacialmente (SORS) es diferente de la espectroscopia de Raman convencional.
Combina la propiedad de propagación de la luz a través de materiales de dispersión difusa junto con la espectroscopia Raman para llevar a cabo el análisis real a través del contenedor.
A diferencia de la espectroscopia de Raman convencional, en la que la señal de Raman se recoge de la zona de iluminación del láser, la SORS emplea la iluminación y las zonas de recogida cercanas al punto que se desplazan mutuamente mediante una compensación física (Figura 3).

En esta configuración compensada, gracias a la propagación del láser en el interior del analito, los fotones Raman que se recogen en el área de detección proceden, en su mayoría, de debajo de la superficie de la muestra. Esta configuración ofrece un espectro que contiene gran cantidad de información sobre el material que se encuentra por debajo de la superficie. En cambio, el espectro que se genera con una compensación física reducida o incluso nula, ofrece un espectro con gran cantidad de información de la capa superior de la superficie. A la hora de identificar la materia prima a través de un contenedor, el espectro con gran cantidad de información sobre el contenedor y con compensación nula se puede sustraer del espectro compensado con información sobre la materia prima. El espectro que se obtiene como resultado corresponde a un espectro de materia prima sin rastros del contenedor que puede servir para fines de verificación de la identificación.
A diferencia de la espectroscopia de Raman convencional, la SORS puede llevar a cabo las pruebas de identificación con total fiabilidad a través de una gran variedad de contenedores transparentes y opacos. Es capaz de identificar correctamente los materiales que se encuentran dentro de botellas de color ámbar, big bag, sacos con varias capas, recubrimientos de plástico transparentes y de color y contenedores de polietileno opacos de colores.
Los espectrómetros de SORS son especialmente eficaces a la hora de identificar materiales con una sección transversal Raman entre débil y baja a través de contenedores transparentes. Estos espectrómetros SORS emplean detectores de dispositivo de carga acoplada (CCD) de elevada sensibilidad para captar una señal de compensación muy atenuada y, como consecuencia, la señal débil de un dispersor bajo en una configuración cero.
Experimento
Para demostrar la capacidad del instrumento Vaya en la diferenciación de las materias primas de biofarmacéutica entre sí, se adquirieron una serie de materias primas corrientes.
Todas las muestras eran de calidad de reactivo Sigma Aldrich y se suministraban en contenedores transparentes y no transparentes. Las muestras se midieron a su recepción. Las muestras representaban cinco tipos de materias primas biológicas: aminoácidos, tampones biológicos, medios de cultivo celular, surfactantes y sales inorgánicas. Entre las muestras figuraban:
- Tampones biológicos: HEPES, un tampón de Good, o ácido 2-[4-(2-hidroxietil)piperazin-1-il] etanosulfónico, CHES o ácido 2-(ciclohexilamino) etanosulfónico y TRIS o 2-amino- 2-(hidroximetil) propano-1,3-diol. Los tres tampones se recibieron en contenedores de polietileno blancos.
- Surfactantes: Triton X100i o 2-[4-(2,4,4-trimetilpentano-2-il) fenoxi] etanol, PEG o polietilenglicol y polisorbato 80 (PS 80). Triton X100 y PEG se recibieron en contenedores de polietileno blancos. El polisorbato 80 se recibió en una botella de color ámbar.
- Aminoácidos: L-alanina, L-fenilalanina y glicina. Los tres aminoácidos se recibieron en contenedores de polietileno blanco.
- Medios de cultivo celular: F10 y RPMI-1640 HAM. Debido a su cantidad tan reducida, los medios de cultivo celular se transfirieron a un vial de vidrio y a un pequeño contenedor de PE translúcido (sin color).
- Sales inorgánicas: Dihidrogenofosfato de potasio, dipotasio hidrogenofosfato y fosfato cálcico (TCP). Las tres sales se recibieron en contenedores de polietileno blancos.
En cada tipo de materia prima se obtuvo el espectro Raman de cada material directamente a través del contenedor mediante el instrumento Raman Agilent Vaya. El espectro de los materiales de cada uno de los tipos se superpuso posteriormente con fines de diferenciación. Las medidas de los cinco tipos de materiales se llevaron a cabo en los contenedores tal y como se recibieron por parte del fabricante (a menos que se especifique lo contrario), como se muestra en la Figura 4.

Las condiciones analíticas que se emplearon para adquirir cada barrido se establecieron automáticamente en el instrumento sin la intervención del usuario. Todas las muestras se analizaron a temperatura ambiente y con las condiciones de iluminación ambientales (luces de LED Sun). Cada barrido tardó como máximo 35 segundos en realizarse. Se llevó a cabo una prueba de cualificación del rendimiento antes de la adquisición de los espectros Raman y SORS.
Resultados y comentarios
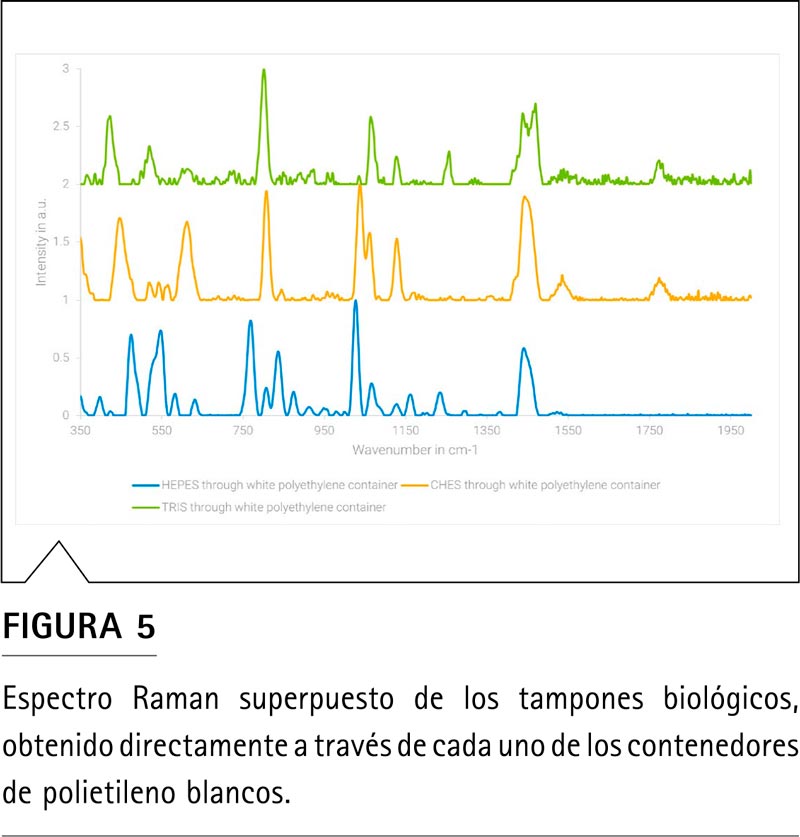
El espectro Raman de los tampones HEPES, CHES y TRIS se muestran en la Figura 5. Los tres espectros muestran bandas Raman diferentes y específicas que se pueden emplear para la identificación y especiación de los tampones antes de devolverlos a su curso para su uso en los procesos anteriores. Especialmente en el caso de HEPES y CHES, la diferenciación es sencilla si se emplean las bandas alicílicas en la región de entre 600 y 1300 cm-1, a pesar de compartir parcialmente su estructura principal.
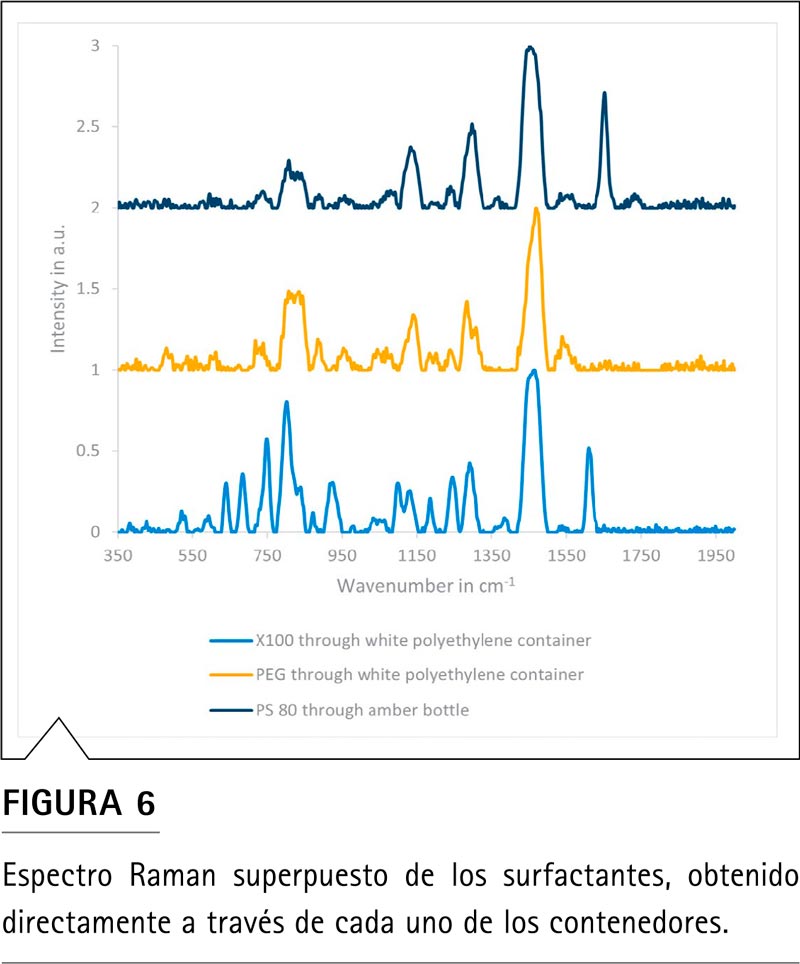
Los espectros Raman de los surfactantes Triton X100, PEG y PS 80 se muestran en la Figura 6. Triton X100, PEG y PS 80 se pueden diferenciar de forma sencilla entre sí.
La banda a ~1.650 cm-1 en el espectro Raman del PS 80 es característica de la presencia del grupo monooleato y, en gran parte, es responsable de la diferenciación con los otros dos surfactantes. La banda a ~1.615 cm-1 en el espectro Raman del Triton X100 indica la presencia de un anillo aromático y contribuye a la diferenciación de los tres surfactantes.
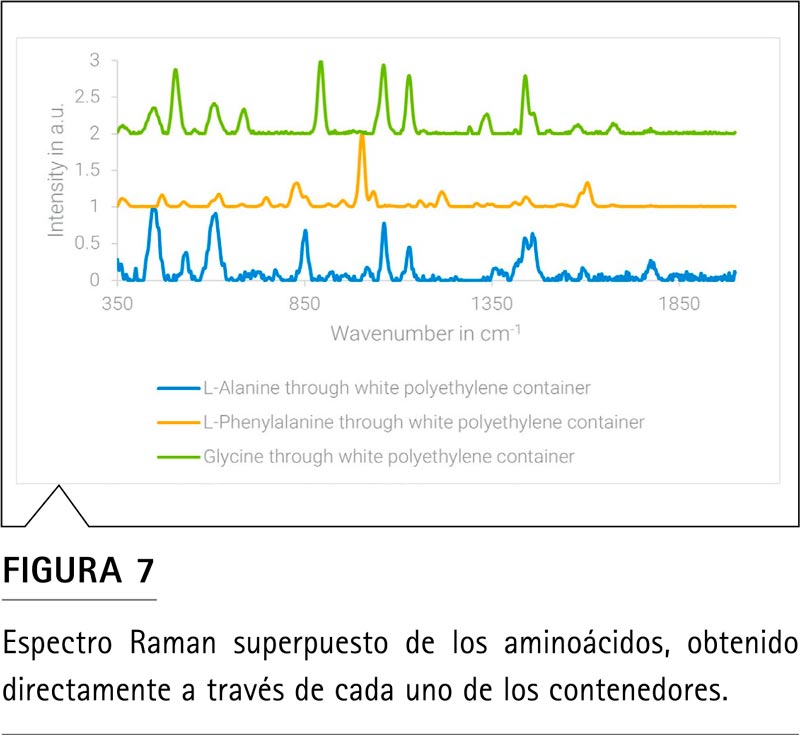
En la Figura 7 se muestra la superposición de los aminoácidos L-alanina, L-fenilalanina y glicina. Estos tres aminoácidos se pueden diferenciar de forma sencilla por sus marcadores específicos (2). En el caso de la alanina, la presencia de una banda intensa a 852 cm-1 es un factor claro de diferenciación en comparación con otros aminoácidos alifáticos. En el caso de la glicina, es la presencia de dos bandas a 894 cm-1 (Cα–C;OCO; COO de pico simétrico) y 1.327 cm-1 (N–Cα–H; NH3 con elevación asimétrica; NH3 con elevación asimétrica; N–Cα–Hα) la que permite la especiación. En el caso de la fenilalanina, la banda a 1.005 cm-1 (anillo δ) de la respiración del anillo es la que permite una especiación sencilla en comparación con otros aminoácidos aromáticos y con aminoácidos alifáticos más sencillos.
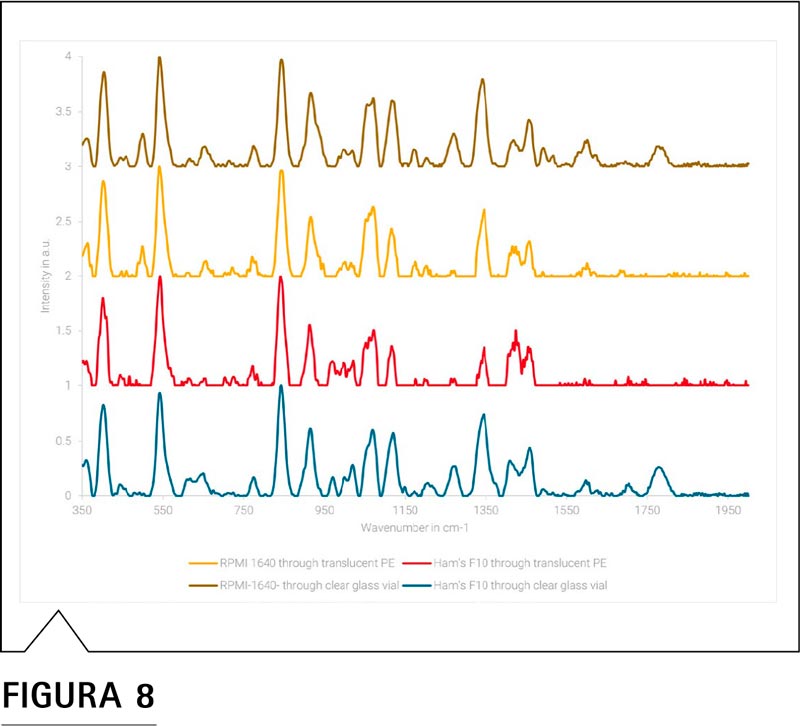
En la Figura 8 se muestra la superposición de los espectros de los medios de cultivo celular RPMI-1640 y F10 de Ham. La espectroscopia SORS, bien a través de un vial transparente o bien a través de un contenedor translúcido de polietileno, es capaz de diferenciar estos dos medios de polvo seco (DPM). Estos DPM están compuestos, en su mayoría, por sales iónicas inorgánicas inactivas para Raman, como el cloruro de sodio, y por materiales activos para Raman, como el azúcar y los tampones (iónicos y orgánicos). Un bajo porcentaje de masa de materiales activos Raman como aminoácidos, vitaminas y sales inorgánicas constituyen estos DPM. Por lo tanto, los espectros Raman que se obtienen reflejan parcialmente la composición del DPM y la diferenciación se basa, en gran medida, en los componentes con alto porcentaje de masa activa Raman y/o alta sección transversal de dispersión Raman (σ). A pesar de que la espectrometría SORS no puede emplearse como medio para comprobar de forma precisa la composición, puede convertirse en un método ágil para diferenciar los envíos que se reciben de DPM basándose en los componentes de alto porcentaje de masa o de elevada sección transversal del DPM.
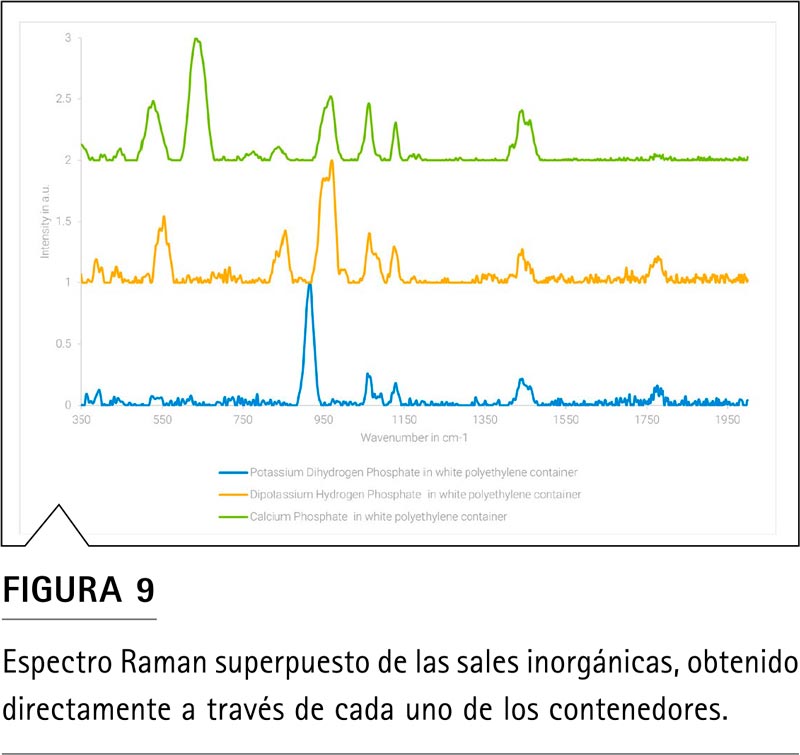
En la Figura 9 se muestra la superposición del espectro de las sales inorgánicas que se utilizan habitualmente. La espectroscopia SORS es capaz de diferenciar los tres derivados del fosfato, independientemente del nivel de protonación del núcleo de fosfato y del contraión.
Conclusión
La espectroscopia SORS que proporciona el instrumento Raman Agilent Vaya fue capaz de diferenciar correctamente las materias primas biofarmacéuticas sin necesidad de abrir los contenedores.
Se obtuvieron espectros de calidad suficiente de cada materia prima, a través del contenedor, en menos de 35 segundos. El espectro sirvió para diferenciar una materia prima de otra del mismo tipo de material.
Incluso fue posible medir los materiales que se encontraban dentro de contenedores translúcidos, como los medios en polvo seco del estudio. Los resultados demuestran la eficacia de SORS a la hora de sustraer los contenedores de una gran variedad de materiales que se utilizan en los procesos iniciales.
Agilent Vaya ofrece tiempos de análisis rápidos y la capacidad de realizar mediciones a través de contenedores transparentes y opacos, por lo que es perfecto para su uso con grandes volúmenes de materias primas biofarmacéuticas. Es posible identificar las materias primas en cuarentena inmediatamente a su recepción. El instrumento Raman Vaya reduce una gran cantidad de pasos necesarios, o los elimina, durante el uso de FTIR o de la espectroscopia de Raman convencional, como la limpieza de la cabina de muestreo, la transferencia de contenedores al área de cuarentena y fuera de ella para el muestreo o el análisis, etc. Además, conserva la esterilidad de las materias primas y reduce los costes asociados a su deterioro.
Referencias
- Chess EK, Bairstow S, Donovan S, Havel K, Hu P, Johnson RJ, Lee S, McKee J, Miller R, Moore E, Nordhaus M, Ray J, Szabo C, Wielgos T. Case study: contamination of heparin with oversulfated chondroitin sulfate. Handb Exp Pharmacol. 2012;(207):99-125. doi: 10.1007/978-3-642- 23056-1_6. PMID: 22566223.
- Raman Spectra of Amino Acids and their aqueous solutions. Spectrochimica Acta Part A 78, 2011, 1187- 1195.
Autores: Frédéric Prullière Christopher Welsby Agilent Technologies, Inc.
Más información:
www.agilent.com