Cuantificación de Tenofovir y sus impurezas en productos Farmacéuticos multicomponentes, por Cromatografía de Gradiente inverso

Cuantificación de Tenofovir y sus impurezas en productos Farmacéuticos multicomponentes, por Cromatografía de Gradiente inverso (doble bomba ternaria) con detector de Aerosol Cargado ( CAD )
Autor: Katherine Lovejoy
Thermo Fisher Scientific, Germering,
Alemania
Beneficios de la aplicación
Mejora la cuantificación de los analitos cargados con un solo calibrador teniendo en cuenta su formación de sal con aditivos de fase móvil
Ilustra la capacidad de usar la compensación de gradiente inverso para normalizar la respuesta del detector cuando se usa un gradiente ternario (tres eluyentes)
Introducción
La combinación de fármacos antirretrovirales de emtricitabina y tenofovir disoproxil (TD) se usa para tratar a pacientes con VIH. La determinación del perfil de impurezas mediante cromatografía de fase reversa es difícil porque están presentes tanto las impurezas hidrófobas polares de elución temprana como las de elución tardía (ver la Figura 1 para las estructuras químicas). Un método desarrollado anteriormente utilizaba un gradiente ternario con detección UV para perfilar las impurezas en 10 minutos. Desafortunadamente, la respuesta del detector de UV depende de la naturaleza del cromóforo presente. Los dos ingredientes farmacéuticos activos (API) medidos tenían coeficientes de extinción muy diferentes, por lo que la cuantificación mediante detección UV requería estándares individuales para los API y todas las impurezas, un inconveniente importante para muchos métodos donde los estándares de referencia individuales no están disponibles.
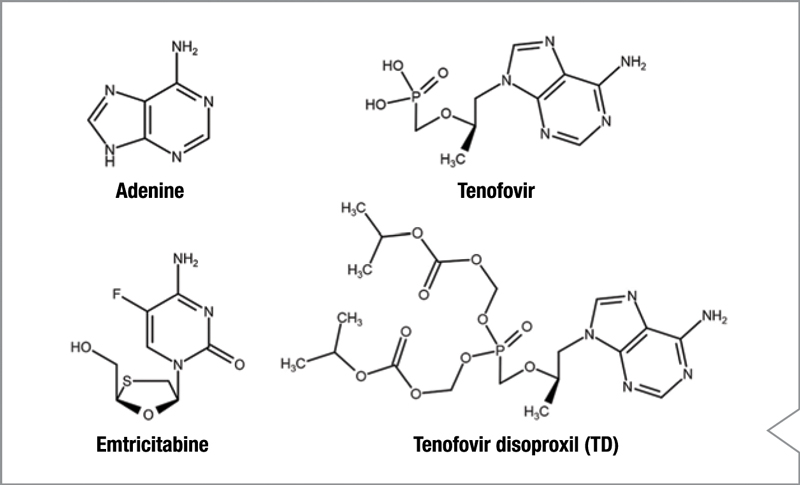
Figure 1. Structures of components in the test mixture
La detección de aerosoles cargados muestra una respuesta uniforme para todos los compuestos no volátiles, independientemente de la estructura química. Por tanto, permite la cuantificación de todos los componentes no volátiles de la muestra con un solo calibrante. Aunque la respuesta del detector de aerosol cargado (CAD) es independiente de la naturaleza de la molécula, depende de la composición del disolvente de la fase móvil. Específicamente, la respuesta durante un gradiente aumentará a medida que aumenta la cantidad de disolvente orgánico. Para abordar este problema, se aplica un gradiente de compensación después de la columna para que el CAD siempre experimente la misma composición de disolvente y la respuesta del detector sea uniforme. Este enfoque se ha aplicado ampliamente solo a gradientes binarios. Sin embargo, debido a las limitaciones analíticas del gradiente binario, se requiere un gradiente ternario para separar rápidamente el par de picos críticos adenina y tenofovir con buena resolución.
En este trabajo se muestra por primera vez la capacidad de utilizar un gradiente ternario inverso y su aplicación al análisis de una mezcla de fármacos antivirales. Con el gradiente ternario, se compara la precisión cuantitativa CAD con y sin gradiente inverso.
También se evalúa la comparación de la precisión cuantitativa del CAD y un detector UV. Finalmente, se presenta una estrategia simple para tener en cuenta la formación de sal entre los analitos cargados y los aditivos de la fase móvil (acetato en este ejemplo) en la respuesta del detector.
Experimental
Sistema de agua y productos químicos
Acetonitrilo, Fisher Scientific ™ Optima ™ LC / MS grado (N / P A955)
Metanol, grado LC / MS Fisher Scientific ™ Optima ™ (P / N A456)
Ácido acético, Fisher Scientific ™ Optima ™ LC / MS grado (N / P A113)
Thermo Scientific ™ Barnstead ™ GenPure ™ xCAD Plus Sistema de purificación de agua ultrapura (N / P 50136171)
Instrumentación
Thermo Scientific ™ Vanquish ™ Flex Duo UHPLC sistema para gradiente inverso que consta de:
Sistema Base (P/N VF-S01-A-02)
Bomba Dual F (P/N VF-P32-A-01)
Muestreador Split FT (P/N VF-A10-A-02)
Compartimiento de Columna H (P/N VH-C10-A-02)
Detector F de aerosol cargado Thermo Scientific ™ Dionex ™ Corona ™ Veo ™ / Thermo Scientific ™ Vanquish ™ (P / N VF-D20-A)
Detector de longitud de onda variable F (P/N VF-D40-A)
Capilares como se muestra en la Figura 2 o Thermo Scientific ™ Vanquish ™ Duo para el kit de capilares de gradiente inverso (N / P 6036.2010)
Preparación de la muestra
Se utilizaron estándares de la USP para tenofovir, emtricitabina y tenofovir disoproxil fumarato. Se prepararon muestras de 1,0 mg / mL en agua. La adenina se preparó a 0,1 mg /ml en ácido acético al 0,1% por razones de solubilidad. Los estándares de calibración de tenofovir disoproxil fumarato se prepararon a 2000, 1000, 500, 200, 100, 50, 40, 30, 20, 10, 7,5 y 5 µg / ml en agua. Todos los demás analitos se prepararon a concentraciones de 50, 40, 30, 20, 10, 7,5 y 5 µg / ml en agua. Las muestras se midieron por quintuplicado. TD se formula como la sal fumarato, pero el fumarato se separa de TD en la columna. Por tanto, 1 mg de sal contiene 0,82 mg de TD. Esto se tiene en cuenta al evaluar las curvas de calibración.
Preparación de la fase móvil
El eluyente A se preparó añadiendo 1 ml de ácido acético a 1000 ml de agua y el pH resultante fue 3,5. Se utilizaron metanol y acetonitrilo de calidad. Espectrometría de masas como eluyentes B y C, respectivamente. Los disolventes orgánicos se renovaron semanalmente para reducir el ruido de fondo.
Condiciones cromatográficas
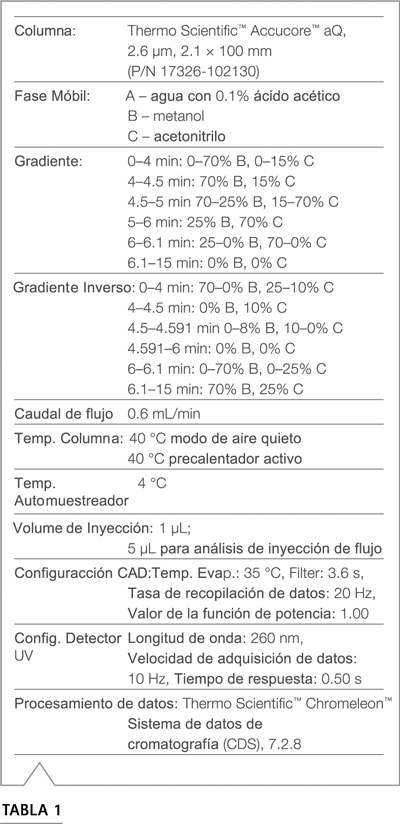
Tabla 1. Condiciones cromatográficas para el análisis de impurezas de TD fumarato
Rutas de flujo
Las trayectorias de flujo para los gradientes analíticos e inversos se muestran en la Figura 2. Se utilizaron dos columnas. La columna en la trayectoria del flujo del segundo gradiente compensatorio elimina las impurezas del disolvente que pueden detectarse en el CAD como variaciones de la línea de base. Incluso los disolventes de grado MS pueden contener impurezas que son invisibles para MS pero visibles para CAD.
Gradientes
La relación entre la cantidad de analito y la respuesta CAD cambia durante la elución del gradiente debido a la influencia de la composición del solvente eluyente en el proceso de nebulización. Por lo tanto, se adoptó un enfoque de bomba doble para normalizar la respuesta entre analitos. Una bomba produjo el gradiente analítico que fluyó a través del muestreador automático y la columna analítica, y una segunda bomba produjo un gradiente de compensación para garantizar que el CAD experimentara una composición de disolvente constante. La ruta del flujo se muestra en Figura 2. Cuando se usa la compensación de gradiente, es importante incorporar un tiempo de retardo para que el gradiente inverso tenga en cuenta las diferencias de volumen entre las rutas de flujo analítico y de compensación (en este caso debido al volumen de permanencia adicional del muestreador automático). Este tiempo de retardo se programa fácilmente en el método de gradiente usando el asistente de fluidos en Chromeleon CDS, que se describe en detalle en la Referencia 3. Con gradientes binarios, es relativamente sencillo hacer coincidir el gradiente analítico con un gradiente de compensación inverso exacto. En el ejemplo de gradiente binario que se muestra en la Figura 3, el CAD siempre recibe el 50% del eluyente B. Para un gradiente ternario, no siempre es posible que el gradiente de compensación coincida con el gradiente analítico durante todo el ciclo. El gradiente ternario utilizado en esta aplicación se muestra en la Figura 4. Los primeros 4,5 minutos del gradiente analítico se utilizan para separar todos los analitos y, durante este tiempo, la composición del disolvente se emparejó eficazmente con un gradiente inverso. Después de 4,5 min, se usa el gradiente analítico para lavar la columna. Durante este paso de lavado, no eluyen analitos y el gradiente analítico no se compensa completamente.

Figura 2. Ruta de flujo para el gradiente inverso
Figura 3. Ejemplo de gradiente inverso para el eluyente B de un sistema convencional de dos
eluyentes. La sincronización del gradiente inverso se retrasa porque la trayectoria del flujo es más corta. Una razón por la que la trayectoria del flujo de gradiente inverso es más corta es porque el gradiente inverso no pasa a través del muestreador automático. El asistente establece una composición de eluyente constante en función del gradiente analítico. Las condiciones óptimas para una respuesta uniforme son una composición de eluyente constante en todo el método de gradiente, pero no necesariamente una composición 50:50.
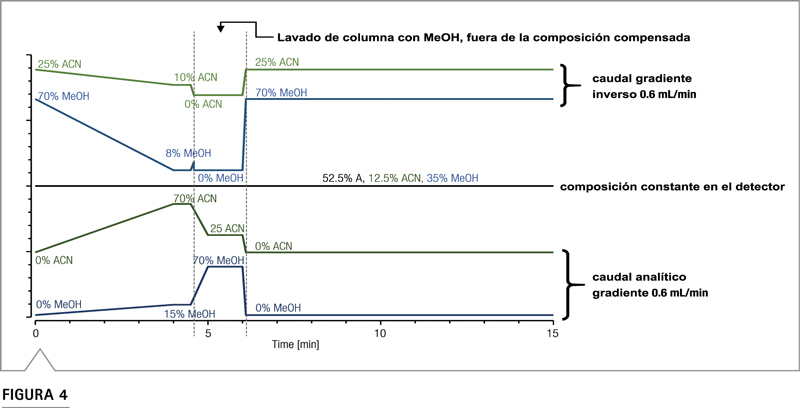
Figura 4. Gradiente ternario implementado con gradientes analíticos (abajo) e inversos (arriba). La composición resultante en el detector es 52,5% de A, 12,5% de acetonitrilo y 35% de metanol.
Resultados y discusión
Entre los detectores de HPLC comunes, el CAD proporciona la respuesta más uniforme entre los analitos no volátiles y, al mismo tiempo, detecta muchos semivolátiles. Debido a la uniformidad de respuesta del CAD, donde la magnitud de la señal medida es similar para numerosos analitos no volátiles e impurezas a la misma concentración, se puede usar un solo calibrante (uno de los
API en este ejemplo) para la cuantificación de impurezas.
Esta es una gran ventaja sobre otros enfoques analíticos que requieren la disponibilidad de estándares de impurezas.
Ventajas del gradiente inverso
La Figura 5 muestra las curvas de calibración sin (A) y con 0.35 gradiente inverso (B). El gradiente inverso sirve para normalizar la altura y el área del pico en relación con el gradiente analítico y para reducir la deriva de la línea base. Se proporciona más información sobre el gradiente inverso en una nota técnica reciente sobre el tema de la uniformidad de la respuesta CAD.
El efecto compensador del gradiente inverso se muestra en los cromatogramas de la Figura 6. Sin compensación, la respuesta del analito aumenta a medida que aumenta el contenido orgánico de la fase móvil, de modo que la respuesta del TD de elución tardía es mucho mayor de los que eluyen más temprano. Cuando se aplica la compensación de gradiente, todas las áreas de picos coinciden y, como se ve en la Figura 5, todas las curvas de respuesta coinciden. La Tabla 2 muestra que el uso del gradiente inverso llevó las áreas de los picos de los cuatro analitos a aproximadamente un 8% de RSD entre sí a 30 ng, casi una mejora de diez veces en el 74% de RSD de las áreas de picos sin el gradiente inverso.
Como se describe a continuación para los analitos que eluyen como solutos cargados, se puede lograr una mejora adicional en la uniformidad de la respuesta y, por lo tanto, la precisión de la cuantificación de un solo corrección de sal asumiendo que todos los analitos existen como calibrante corrigiendo la formación de sal.
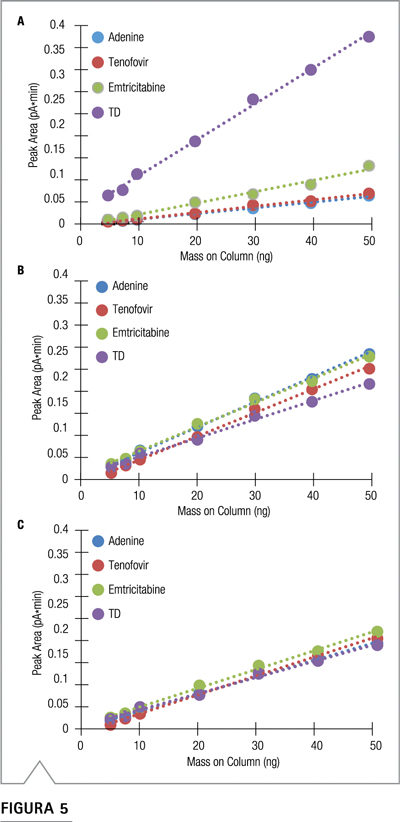
Figura 5. Curvas de calibración para TD e impurezas (A) sin compensación de gradiente inverso, (B) con compensación de gradiente inverso y (C) con compensación de gradiente inverso y cationes cargados individualmente (+1 ) en el eluyente.
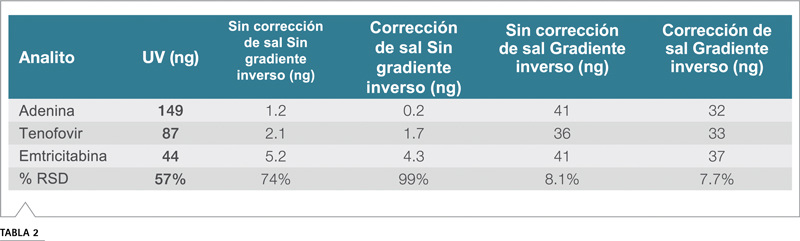
Tabla 2. Comparación de los datos de un solo calibrador para 30 ng antes y después de la corrección de sal. El cálculo de la corrección de sal asumió un acetato por molécula.
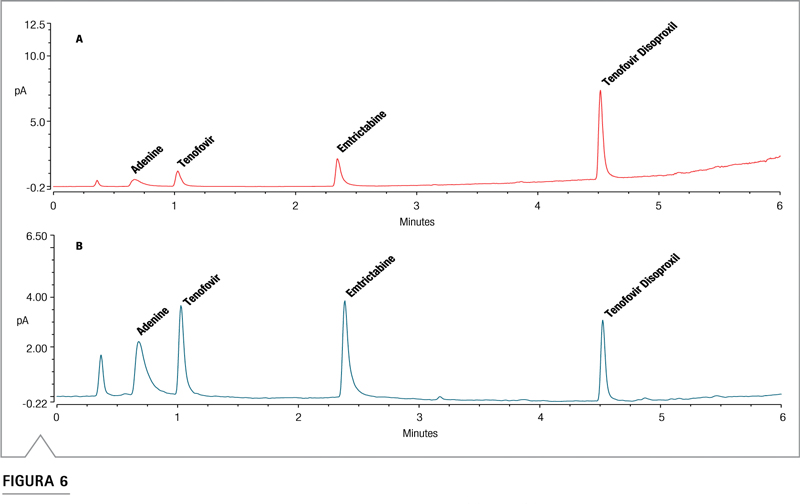
Figura 6. Comparación de cromatogramas para 20 ng en columna de cada sustancia sin (A) o con (B) compensación de gradiente inverso
En la Figura 7 se muestra un análisis de 30 ng de todas las sustancias cuantificadas mediante la curva de calibración TD. Las concentraciones de adenina, tenofovir y emtricitabina se evaluaron como si estas tres sustancias fueran impurezas desconocidas para las que no se pudieran generar curvas de calibración.
Se comparan los valores cuantitativos obtenidos por UV, CAD sin compensación de gradiente y
CAD con compensación de gradiente. Los últimos resultados también se corrigieron por la formación de sal como se detalla a continuación. La cuantificación de API e impurezas utilizando TD como calibrante único es más precisa cuando se utiliza CAD con compensación de gradiente inverso. Con este enfoque, la variación (RSD) de la cantidad entre analitos fue solo del 7,7%.
En comparación, los valores obtenidos por cuantificación de un solo calibrante diferían hasta 5
veces (57% RSD) cuando se usa UV y hasta 25 veces (99% RSD) cuando se usa CAD sin compensación de gradiente inverso.
Como se señaló anteriormente, la RSD del 7,7% entre los analitos se obtuvo con compensación de gradiente y corrección por formación de sal. Los factores adicionales, no relacionados con la detección, que pueden contribuir a esta variación pueden incluir la pureza del analito, la estabilidad y la higroscopicidad del polvo.
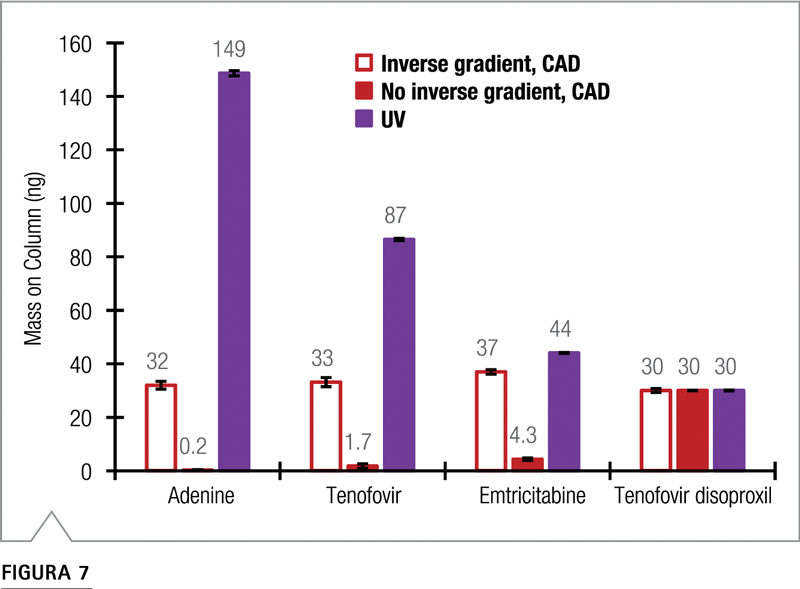
Figura 7. Resultados de cuantificación para 30 ng de cada analito usando TD como un único calibrante por CAD con y sin gradiente inverso y por detección UV. Los conjuntos de datos CAD incluyen correcciones para la formación de sales de acetato.
Corrección de la formación de sal
En las partículas resultantes del proceso de evaporación CAD, los analitos que están cargados positiva o negativamente en solución se asociarán con un contraión para formar sales. Como estas sales tienen masas más altas que los analitos mismos, la respuesta aumentará. Es particularmente probable que los contraiones de la fase móvil influyan en la respuesta y aumenten la masa del analito debido a su alta concentración. Una nota técnica extensa sobre la respuesta uniforme CAD proporciona información adicional sobre diversas estrategias de formación de sal y respuesta CAD.
Es probable que todos los analitos de la mezcla de muestra analizada tengan una carga de +1 a pH 3,5 porque el punto isoeléctrico de cada uno de los analitos está por encima de 3,5. Un heteroátomo de nitrógeno de cada molécula se carga positivamente individualmente a este pH. El único grupo funcional ácido, el ácido fosfónico de tenofovir, no tiene carga a pH 3,5. Por lo tanto, es casi seguro que todos estén asociados con un contraión acetato del exceso de acetato en la fase móvil.4 La siguiente corrección de respuesta simple explica el aumento de masa del analito debido a la formación de sal:
![]()
Utilizando el supuesto de un acetato por molécula, las concentraciones estimadas para 30 ng de adenina, tenofovir y emtricitabina utilizando el conjunto de datos recopilado con el gradiente inverso se resumen en la Tabla 2. Las curvas de calibración para estos dos casos se muestran en (B) y ( C) de la Figura 5. Cuando no se corrigió por la formación de sal, las masas se sobreestimaron hasta en un 33%.
Si se desconoce el estado de ionización, como en el caso de impurezas u otras sustancias desconocidas en una muestra, el efecto de la formación de sal se puede minimizar eligiendo aditivos de fase móvil de bajo peso molecular. Por ejemplo, el ácido fórmico agrega solo 45 Da a la masa molecular de una sustancia y es preferible al ácido trifluoroacético (TFA) (+113 Da), al ácido acético (+59 Da) o al ácido heptafluorobutírico (HFBA) (+213 Da). Por lo tanto, aunque una sal de mayor masa generalmente da como resultado mejores límites de detección, una sal de menor masa mejora la precisión de cuantificación de las incógnitas.
Las fases móviles de pH bajo, como el ácido fórmico al 0,1%, que son comunes en la cromatografía de fase reversa, garantizan que la mayoría de los analitos ácidos sean neutrales mientras que la mayoría de los analitos básicos estén protonados.
Esta elección de pH controla la distribución del estado de protonación, reduciendo así la inestabilidad del tiempo de retención y la cola de los picos. En estas condiciones, los analitos básicos ganarán masa debido a la formación de sal y los analitos ácidos no se verán afectados en gran medida.
Análisis de inyección de flujo para determinar la estrategia de corrección de sal
El análisis de inyección de flujo, donde la columna de separación se reemplaza por una bobina de presión, permite un estudio rápido de los analitos cuyos estándares individuales están disponibles. Esto puede usarse para examinar la influencia del pH de la fase móvil y el tipo de aditivo (peso molecular) en la respuesta del analito. El uso de esta técnica permitió una evaluación más rigurosa de la formación de sal con contraiones de fase móvil. En una nota técnica se comentan ejemplos adicionales de análisis de formación de sal mediante análisis de inyección de flujo.
Se analizó una muestra de 500 ng de cada compuesto con una fase móvil de 52,5% A, 35% B y 12,5% C, cuando A era agua o ácido acético al 0,1%, B era acetonitrilo y C era metanol. En teoría, como los analitos se cargan a pH 3,5 y el acetato está presente en exceso en la gota nebulizada, la formación de sal aumentará la masa del analito y la respuesta del detector. Los resultados confirman que la introducción de acetato agrega masa a las cuatro sustancias (Figura 8). La corrección de las áreas de los picos asumiendo que el detector responde a un acetato por molécula produce una desviación estándar relativa muy baja del 6,2% en el área de los picos para estos cuatro analitos diferentes (Tabla 3). Estos resultados apoyan la conclusión de que si la información sobre la protonación esperada de la impureza se conoce de antemano, las suposiciones sobre la formación de sal pueden integrarse en la curva de calibración. Cuando no se dispone de estándares individuales, las incógnitas se pueden estudiar cromatográficamente examinando el efecto de diferentes aditivos de peso molecular (por ejemplo, ácido fórmico frente a TFA al mismo pH) sobre la respuesta.
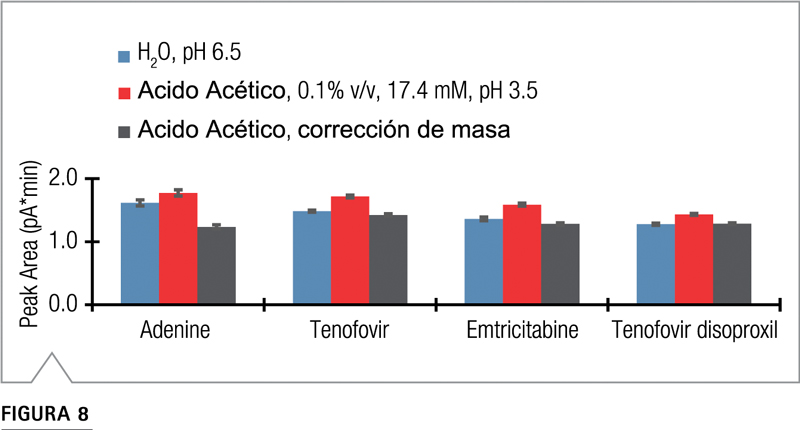
Figura 8. Resultados del experimento de inyección de flujo que cuantificó el efecto del pH sobre la respuesta. Se utilizó un capilar de restricción e inyecciones de 500 ng. La adenina se preparó en ácido acético al 0,1% en lugar de agua por razones de solubilidad.
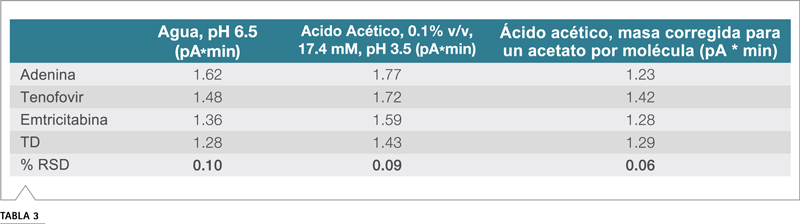
Tabla 3. Áreas de picos de inyección de flujo
Conclusiones
la compensación de gradiente inverso permite la cuantificación de impurezas de sustancias desconocidas al compensar las diferencias en la eficiencia del nebulizador durante el gradiente.
Un gradiente ternario ofrece una mayor flexibilidad cromatográfica y se puede utilizar con un gradiente inverso producido por una bomba de gradiente dual.
Los analitos que se cargan en solución pueden formar sales con aditivos de fase móvil. La influencia del aditivo de la fase móvil en la respuesta CAD se puede minimizar mediante el uso de un aditivo de masa molar baja (ácido fórmico mejor que el ácido acético) y maximizar con aditivos de masa molar mayor como TFA y HFBA. El efecto es más pronunciado para analitos de masa molar inferior, especialmente analitos volátiles.
Se puede utilizar un solo calibrante para cuantificar los niveles de otras sustancias en una muestra, como impurezas para las que no se dispone de estándar. Para los métodos de gradiente, se recomienda la compensación de gradiente inverso. Para los analitos ionizables, las
correcciones por posible formación de sal pueden proporcionar los resultados más precisos. Para uso exclusivo en investigación.
Referencias
Fabel, S. Ternary gradient for tenofovir disoproxil fumarato impureza perfilado, Thermo Fisher Scientific Application Note 1129. https://assets.thermofisher.com/TFS-Assets/CMD/ApplicationNotes/
AN-1129-LC-Ternary-Gradient- Tenofovir-AN71676-EN.pdf
Iavanya, B. y col. Desarrollo de métodos y validación de la forma de dosificación combinada en tabletas de emtricitabina y tenofovir disproxil fumerato por espectroscopía ultravioleta. En t. Investigación J. Pharm. 2012, 3 (12), 104–108.
Menz, M .; Eggart, B .; Lovejoy, K .; Acworth, I .; Gamache, P .; Steiner, F. Detección de aerosoles cargados: factores que afectan la respuesta uniforme del analito. Nota técnica de Thermo Fisher Scientific 72806. https://assets.thermofisher.com/TFS-Assets/CMD/
Technical-Notes/tn-72806-uhplc-charged-aerosol-detection-tn72806-en.pdf
Cohen, R.D .; Liu, Y .; Gong, X. Análisis de bases volátiles mediante cromatografía líquida de alta resolución con detección basada en aerosoles. J. Chrom. A. 2012, 16 de marzo (1229), 172-179.
Encuentre más en
thermofisher.com/CAD
Más información:
info@sol-analiticas.com
www.sol-analiticas.com
Conozca más sobre cromatografía













