
Determinación simultánea de vitaminas liposolubles y en agua en tabletas y bebidas energéticas

Determinación simultánea de vitaminas liposolubles y en agua en tabletas y bebidas energéticas mediante el uso de un novedoso sistema Vanquish Flex Duo para LC dual
Autores
Sylvia Grosse, Mauro De Pra, Frank Steiner
Thermo Fisher Scientific, Germering, Germany
Beneficios de la aplicación
- Esta configuración de trabajo proporciona un análisis cuantitativo de vitaminas solubles en grasa y en agua en bebidas y tabletas de complementos alimenticios utilizando el sistema Thermo Scientific TM Vanquish TM Flex Duo UHPLC para LC dual.
- Este sistema permite ejecutar dos métodos y columnas separadas en un instrumento, simultáneamente.
Objetivo
Describir una configuración de trabajo para el análisis cuantitativo simultáneo de vitaminas solubles en grasa y en agua en bebidas y tabletas de complementos alimenticios utilizando el sistema Vanquish Flex Duo para LC dual y la columna Thermo Scientific TM Acclaim TM PolarAdvantage II.
Introducción
Las vitaminas son nutrientes esenciales que se encuentran en diversas fuentes alimenticias naturales y complementos alimenticios. Las vitaminas pueden clasificarse como vitaminas solubles en agua (WSV) o vitaminas solubles en grasa (FSV), según su hidrofobicidad. La cromatografía líquida de alta resolución en fase inversa se usa ampliamente para determinar las vitaminas en alimentos, suplementos y bebidas. Debido a la hidrofobicidad dramáticamente diferente de WSV y FSV, el análisis simultáneo de cromatografía líquida con el mismo método es difícil.
Mientras que algunos WSV presentan muy poca retención en fase reversa incluso con fases móviles muy débiles, el FSV eluirá solo con solventes muy fuertes, acercándose al 100% orgánico. Un método de fase inversa, aplicable para una amplia gama de polaridades y al mismo tiempo que proporciona un resultado aceptable en términos de resolución y tiempo de ejecución, no se implementa fácilmente. Se propuso un método para la separación de FSV y WSV en el que dos columnas se operaban secuencialmente en un sistema.1
Para este enfoque, un sistema LC convencional tenía que estar equipado con un par de válvulas de conmutación para conectar la columna seleccionada al inyector y UV detector. El método fue eficaz ya que el análisis de ambas clases de vitaminas se podía realizar sin supervisión. Sin embargo, esta solución requería una configuración de hardware compleja y una programación del sistema de datos de cromatografía aún más compleja. Además, dado que las columnas se ejecutaron una tras otra, el rendimiento fue bajo. Otras aplicaciones avanzadas se informan en la literatura para el análisis simultáneo de ambas clases de vitaminas. Por ejemplo, un enfoque para la separación de FSV y WSV en la misma columna y con el mismo método utilizó la inyección retrasada de la muestra que se esperaba que contenga FSV.
De esta manera2, el FSV altamente hidrofóbico ingresó a la columna solo cuando la fuerza de la fase móvil fue suficientemente alta. El método dependía de la flexibilidad del sistema de datos cromatográficos y del sistema UHPLC. La complejidad de la programación y la configuración del instrumento hizo que la implementación de este enfoque fuera algo engorrosa.
En este trabajo presentamos un flujo de trabajo eficaz para el análisis simultáneo de WSV y FSV que supera los desafíos de todos los enfoques informados anteriormente.
La configuración de trabajo se basa en un novedoso sistema Vanquish Flex Duo para Dual LC. El sistema consta de una bomba doble con dos vías de flujo independientes, un muestreador FT doble con dos puertos de inyección separados y loops de muestra, uno (u opcionalmente dos) compartimentos de columna H y dos sistemas de detección. Permite el uso independiente y simultáneo de dos columnas y métodos diferentes. Gracias a estas funciones avanzadas, se desarrollaron y optimizaron dos métodos independientes para FSV y WSV y se ejecutaron simultáneamente. Esta configuración de trabajo de LC dual ofrece un rendimiento mucho mayor en comparación con la técnica que necesita el cambio de columna mencionado anteriormente1 Además, se eliminan problemas potenciales como la incompatibilidad de las fases móviles en la ruta de flujo compartida; un ejemplo de este problema es la precipitación de sales tampón en niveles altos de disolvente orgánico.
En comparación con la solución anterior, el enfoque con el sistema Vanquish Flex Duo para LC dual que se presenta aquí, es notablemente simple de implementar, permite el uso de métodos mejor optimizados y aumenta el rendimiento gracias al uso simultáneo de dos columnas con dos métodos y un análisis de ciclos más rápido.
Para ambas clases de vitaminas, la columna de fase inversa elegida para ejecutar el flujo de trabajo de LC dual es la columna Acclaim PolarAdvantage II (PA2). La columna presenta una fase estacionaria con incrustación polar que opera eficazmente en una amplia gama de condiciones de fase móvil y es muy adecuada para la separación de componentes con hidrofobicidad muy diversa, como las vitaminas.
Experimental
Químicos
- Agua desionizada (DI) resistividad de 18 MO · cm o superior
- Acetonitrilo, grado Optima ™ LC / MS (Fisher Scientific ™ P / N 100001334)
- Metanol, grado Optima ™ LC / MS (Fisher Scientific P / N 10767665)
- Ácido acético, grado Optima ™ LC / MS (Fisher Scientific P / N 10860701)
- Ácido ortofosfórico, grado HPLC (P / N 10644732)
- DMSO, grado HPLC, (N / P 10387791)
- Hexano, grado HPLC, (N / P 10703611)
- Etanol, grado HPLC, (N / P 10542382)
- Acetona, grado HPLC, (N / P 10131560)
- Dihidrogenofosfato de potasio, p.A. (comprado a un proveedor de confianza)
- Hidróxido de potasio, p.A. (comprado a un proveedor de confianza)
- Bicarbonato de potasio, p.A. (comprado a un proveedor de confianza)
- Vitaminas solubles en agua: ácido ascórbico, cianocobalamina, ácido fólico, nicotinamida, ácido pantoténico, piridoxal, piridoxina, tiamina, riboflavina; grado analítico (comprado a un proveedor de confianza)
- Vitaminas liposolubles: colecalciferol, ergocalciferol, filoquinona, a-tocoferol, acetato de a-tocoferola, dtocoferola, .-tocoferol, retinol, acetato de retinol, palmitato de retinol; grado analítico (comprado a un proveedor de confianza)
Equipamiento
- pHmetro, Thermo Scientific™ Orion™ 3-Star
- Baño de ultrasonidos con regulación de temperatura, Fisher Scientific
- Agitador magnético, Fisher Scientific
- Filtro de jeringa, acetato de celulosa Minisart® (CA) (Ø 26 mm; tamaño de poro de 0,45 µm), (comprado a un proveedor de confianza)
- Tubos cónicos (50 ml), Fisher Scientific (N / P 10788561)
- Viales (ámbar, 2 ml), Fisher Scientific (N / P 15508760)
- Septa (silicona / PTFE), Fisher Scientific (P / N 11548180)
Elaboración de estándares
Se prepararon con agua soluciones madre de cada vitamina soluble en agua (tiamina, ácido ascórbico, piridoxal, piridoxina, nicotinamida, ácido pantoténico y cianocobalamina) a una concentración de 1 mg / ml. Se disolvió ácido fólico en KHCO3 20 mM y riboflavina en KOH 5 mM, ya que no son estables en agua pura.
Se prepararon soluciones madre de cada vitamina liposoluble (retinol, acetato de retinol, palmitato de retinol, ergocalciferol, colecalciferol, d-tocoferol, .tocoferole, a-tocoferola y acetato de a-tocoferola) a una concentración de 1 mg / ml utilizando metanol. Se prepararon menaquinona y filoquinona usando acetona en lugar de metanol debido a una mejor solubilidad.
Los estándares de calibración se prepararon a ocho concentraciones: 100, 50, 25, 10, 5, 1, 0,5 y 0,1 µg / mL, utilizando agua para las vitaminas solubles en agua y metanol para las liposolubles.
La tiamina se calibró usando el método de adición estándar en el rango de concentración de 5 µg / mL a 100 µg / mL agregando la cantidad apropiada de la solución madre de 1 mg / mL al extracto de la muestra preparada de WSV.
Todos los estándares y muestras se introdujeron en viales de vidrio marrón de HPLC y se sellaron
adecuadamente para proteger las soluciones de la luz y la evaporación.
Preparación de muestra de una tableta de vitaminas y una bebida energética La tableta de vitamina y la tableta de placebo (utilizada como matriz en blanco y para la determinación de la recuperación) se compraron en una farmacia local. La bebida energética se compró en un supermercado local. Aquí se describe un protocolo3 de preparación de muestras ligeramente diferente.
Vitaminas solubles en agua en la tableta de vitaminas.
Se pesó una tableta de vitamina y se molió con un mortero. El polvo se transfirió a una botella de 250 ml y se anotó el peso. Se agregaron diez mililitros de DMSO a la botella y luego se sonicaron durante 2 min. A continuación, se añadieron a la solución 90 ml de ácido acético al 2% en agua y luego se agitó durante 1 min. Posteriormente, se extrajo la muestra mediante sonicación; para este propósito, el sonicador se fijó a 40 ° C durante 5 min. Después, la solución se filtró a través de un filtro de jeringa CA con un tamaño de poro de 0,45 µm. Se diluyó una alícuota 1:10 con agua. Las soluciones diluidas y sin diluir se utilizaron para la cuantificación, dependiendo de la cantidad esperada de analito en la muestra.
Se siguió el mismo procedimiento con una tableta de placebo. La tableta de placebo se analizó sin añadir estándar de vitamina para la resta de la matriz de fondo. Además, se le añadió 10 µg / ml de una mezcla estándar de vitaminas para calcular la tasa de recuperación de cada analito. Para ello, se agregaron 10 mL de una solución estándar de 100 µg / mL a la tableta en polvo, se agitó y luego se incubó sin agitar durante 3 min. Posteriormente, se agregaron 10 mL de DMSO
y 80 mL de solución de ácido acético al 2% para que el volumen final de la muestra fuera el mismo volumen que las muestras reales. El procedimiento de preparación de la muestra fue el mismo que el descrito para la tableta de vitamina.
Todas las muestras se prepararon en tres repeticiones y se analizaron inmediatamente después de la preparación.
Vitaminas solubles en agua en la bebida.
La bebida energética se sonicó durante 15 min para desgasificar. Se tomó una alícuota y se diluyó 1:10 con agua. La solución se filtró a través de un filtro de jeringa CA con un tamaño de poro de 0,45 µm directamente en el vial de HPLC para inyección. No se evaluaron las tasas de recuperación.
Vitaminas liposolubles en la tableta de vitaminas.
Se pesó una tableta de vitamina y se molió con un mortero. El polvo se transfirió a una botella de 250 ml y se anotó el peso. Se añadieron ocho mililitros de solución de etanol al 80%, seguidos de 10 ml de hexano. La solución se agitó a mano 10s y se extrajo en un baño de sonicación a 40 ° C durante 10 min.
Luego, la solución se transfirió a un tubo cónico de 50 ml para facilitar la separación de las capas. La capa de hexano se tomó y se filtró a través de un filtro de jeringa CA con un tamaño de poro de 0,45 µm. Una alícuota se utilizó directamente para inyección y una segunda alícuota de la capa de hexano se diluyó 1:10 con hexano. Las soluciones diluidas y sin diluir se utilizaron para la cuantificación, dependiendo de la cantidad de analito en la muestra.
Se tomó el mismo procedimiento con una tableta de placebo. La tableta de placebo se analizó sin añadir estándar de vitamina para la resta de la matriz de fondo.
Además, se le añadió 18 µg / ml de una mezcla estándar de vitaminas para calcular la tasa de recuperación de cada analito. Para ello, se adicionaron 1.8 mL de solución estándar de 100 µg /
mL y se dejaron reposar por 3 min.
Posteriormente se usaron 6.2 mL de solución de etanol al 80% y 10 mL de hexano para llegar al mismo volumen que se usó para las muestras reales. Se siguió el procedimiento descrito para la tableta de vitamina.
Todas las muestras se prepararon en tres repeticiones y se analizaron inmediatamente después de la preparación.
Instrumentación
Sistema Vanquish Flex Duo para LC dual que consta de:
- Base del sistema (P / N VF-S01-A-02)
- Bomba doble F (P / N VF-P32-A-01)
- Muestreador de doble división FT (P / N VF-A40-A-02)
- Compartimento de columna H (P / N VH-C10-A-02) con 2 precalentadores pasivos, 1 µL (P / N 6732.0174)
- 2 detectores de diodos HL (P / N VH-D-10-A), cada uno equipado con una celda de flujo Thermo
- Scientific ™ LightPipe ™ de 10 mm (P / N 6083.0100)
La adquisición y el procesamiento de datos se realizaron con el software Thermo Scientific ™ Chromeleon ™ 7.2.8 Chromatography Data System (CDS).
Método cromatográfico
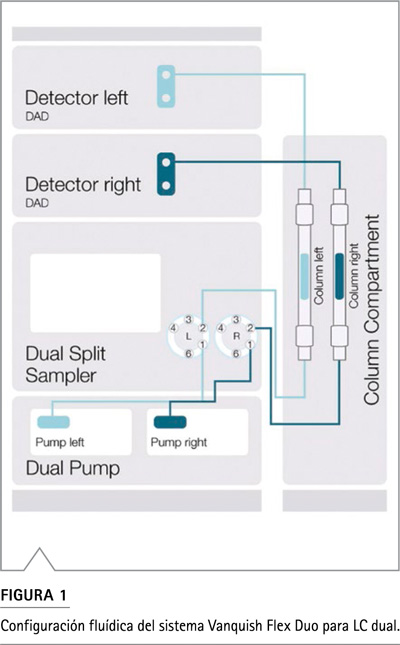
La Figura 1 ilustra la configuración fluídica esquemática del sistema Dual LC utilizado en este estudio.
Resultados y discusión
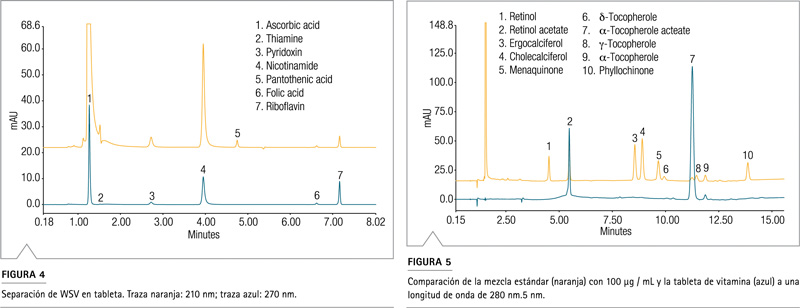
La Figura 2 ilustra la separación de un estándar WSV en una columna Acclaim PA2 con detección a 210 nm. Los analitos polares, ácido ascórbico y tiamina (pico 1 y 2), generalmente se retienen mal y no se resuelven con columnas de fase inversa convencionales, pero el par muestra una retención y resolución adecuadas con la columna Acclaim PA2. El otro par de picos críticos, ácido fólico y cianocobalamina (picos 7 y 8), también está bien separado con Rs> 2.0 (Tabla 5).
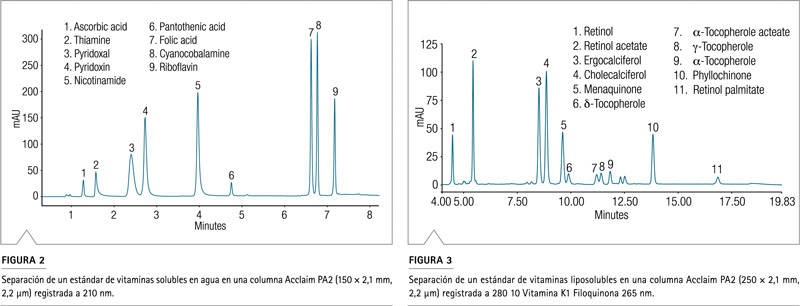
La separación de un estándar FSV se muestra en la Figura 3. La resolución fue superior a 2 para la mayoría de los pares. Las únicas excepciones son el par menaquinona – d-tocoferol (picos 5 y 6, Rs = 1,4) y acetato de a-tocoferol – .-tocoferol (picos 7 y 8, Rs = 1).
Se pueden observar algunos picos no asignados de baja intensidad tanto en la Figura 2 como en la Figura 3. Los picos se consideraron como impurezas desconocidas que se encuentran en algunas de las vitaminas estándar.
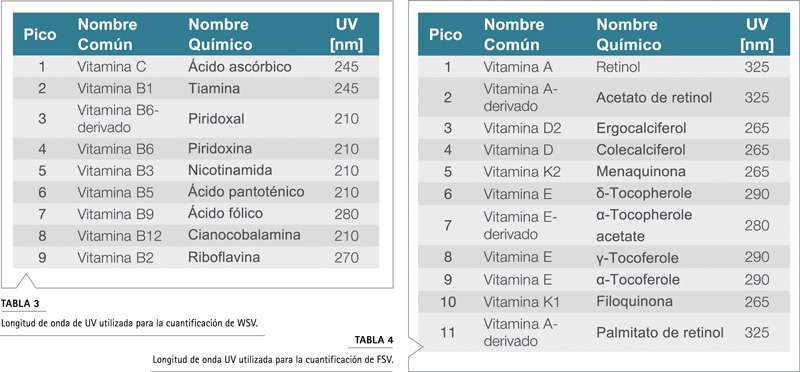
Como la mayoría de las vitaminas muestran una absorción UV diferente, la longitud de onda de detección debe optimizarse para garantizar una cuantificación de alta sensibilidad de todos los componentes. Las longitudes de onda utilizadas para la cuantificación se pueden encontrar en la Tabla 3 y la Tabla 4.
Precisión del método
Las pruebas de repetibilidad se llevaron a cabo inyectando 1 µL de mezclas estándar de 100 µg / ml de vitaminas solubles en agua y grasas diez veces cada una. Los resultados se resumen en la Tabla 5 y la Tabla 6.
Ambos métodos muestran una buena repetibilidad. La desviación estándar relativa del tiempo de retención (RT RSD) fue extremadamente baja para las series de WSV, con valores por debajo del 0,05%. El tiempo de retención de los FSV fue ligeramente menos preciso, debido al gradiente poco profundo requerido para lograr una buena resolución, pero aún así satisfactorio. Para FSV, el tiempo de retención RSD fue del orden del 0,1% para la mayoría de los picos.
La precisión del área de pico para el WSV fue excelente. La RSD fue inferior al 0,3% para todos los picos excepto el ácido ascórbico, que fue del 2,7%. La precisión de área relativamente baja del pico de ácido ascórbico está relacionada con la inestabilidad química inherente de la molécula, que es sensible tanto a la temperatura como a la luz. Esto se confirma con los resultados de estas 10 inyecciones repetidas, en las que el área máxima de ácido ascórbico disminuyó de manera constante inyección tras inyección. El área de RSD del FSV fue en general inferior al 0,5% y ligeramente superior para el retinol y el palmitato de retinol.
Determinación cuantitativa de vitaminas solubles en agua y grasa en una tableta de vitamina y una bebida energética
Como se menciona en la descripción experimental anterior, la cuantificación se realizó con calibración estándar externa para todas las vitaminas excepto la tiamina. La tiamina requirió un enfoque diferente porque la forma de su pico se vio fuertemente afectada por la matriz de la muestra. Cuando la tiamina se disolvió en agua, el pico era ancho y con una fuerte cola; cuando la muestra se disolvió en el placebo procesado, el pico fue más agudo y la integración fue más fácil (resultados no mostrados). Además, el área del pico de una determinada cantidad de tiamina fue mayor cuando la tiamina se disolvió en una solución de placebo en lugar de en agua. No se encontró una explicación de este comportamiento; sin embargo, dada la fuerte influencia de la matriz de la muestra en la forma del pico, se consideró más confiable una calibración por adición de patrón.
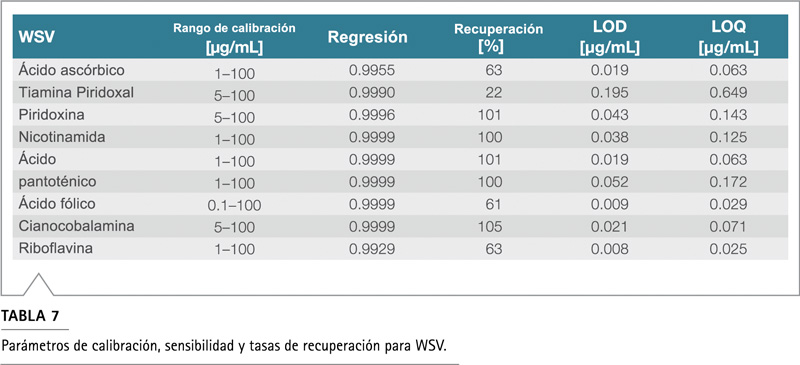
El rango de calibración de los analitos se ajustó en función de las cantidades esperadas de vitaminas en las muestras. La Tabla 7 muestra los resultados de la calibración de vitaminas solubles en agua. Los coeficientes de regresión fueron 0.999 o más para la mayoría de las vitaminas, lo que indica una buena linealidad.
En general, la recuperación fue excelente para las vitaminas que se sabe que son químicamente
estables. Los valores de recuperación fueron bajos para ácido ascórbico, ácido fólico y riboflavina. La baja recuperación de estas moléculas puede explicarse por la baja estabilidad química. Para lograr valores de recuperación más altos para estas moléculas inestables, se debe desarrollar una estrategia de preparación de muestras optimizada. A los efectos de este trabajo, se consideró aceptable la baja recuperación de las moléculas inestables, ya que las cantidades determinadas estaban bien de acuerdo con la cantidad descrita en la etiqueta de la tableta analizada (Cuadro 9)
La tiamina también mostró una baja recuperación. La molécula se considera estable en las condiciones de preparación de la muestra, y la baja recuperación tiene una causa raíz diferente que no pudo ser identificada en el presente trabajo. Sin embargo, al igual que el resto de vitaminas, la cantidad final calculada estuvo de acuerdo con la cantidad etiquetada; por tanto, el método se consideró aceptable.
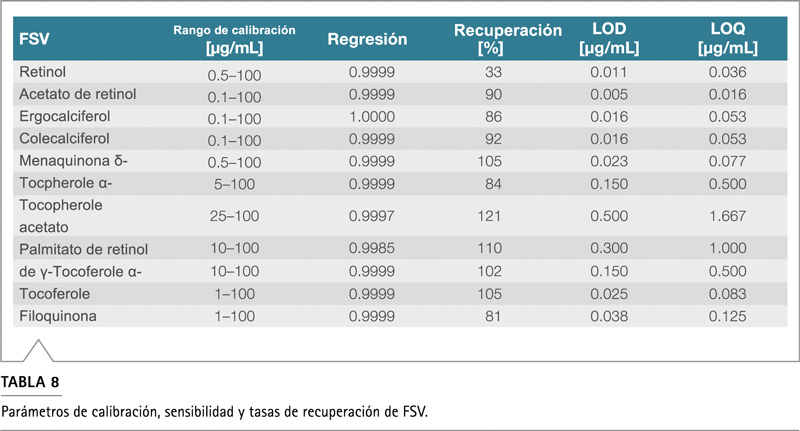
Las FSV muestran tasas de recuperación entre el 81% y el 121%, a excepción del retinol que fue del 33% (Tabla 8). No se detectó retinol en el complemento alimenticio. En general, las tasas de recuperación fueron similares a las informadas anteriormente, 3 cuando se utiliza un método de preparación de muestras similar.
La tableta de vitamina completa se molió y analizó por triplicado. De manera similar, se preparó una tableta de placebo y se usó su cromatograma para la corrección de la línea de base de la muestra. Al hacerlo, los picos de la matriz y del sistema podrían eliminarse del cromatograma. La Figura 4 demuestra la separación de vitaminas solubles en agua en la tableta a dos longitudes de onda diferentes (210 nm y 270 nm). Los resultados cuantitativos se pueden ver en la Tabla 9.
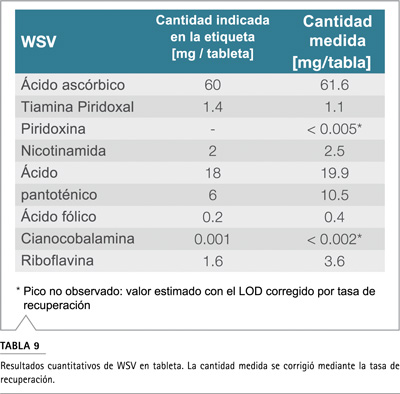
En general, se midieron cantidades más altas que las informadas en la etiqueta del producto. Este aparente desajuste puede explicarse por la práctica común de los productores de nutracéuticos de exceder la cantidad declarada. De esta manera, el productor puede garantizar que la cantidad etiquetada de vitamina esté en el producto incluso si se degrada durante la vida útil del producto. La cantidad de cianocobalamina en la muestra fue menor que el límite de detección y no se pudo determinar con este método. La sensibilidad de los detectores de UV a menudo no es suficiente en el rango de sub ng / mL. Para cuantificar a un nivel tan bajo, se requieren enfoques alternativos como el enriquecimiento de muestras.1
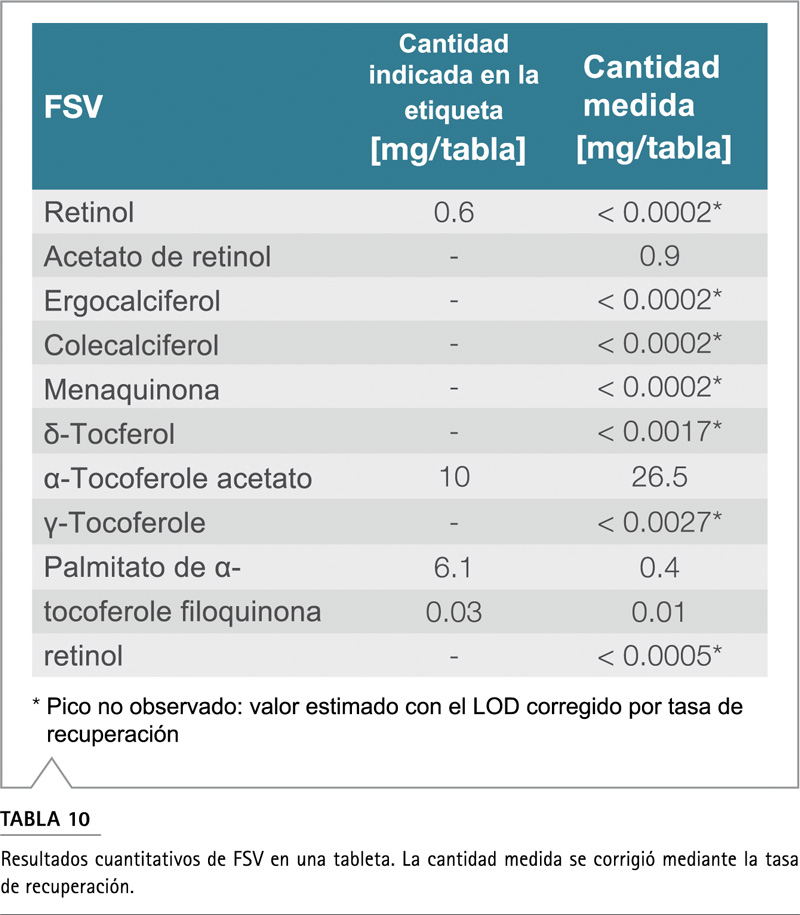
Los resultados del FSV muestran algunas discrepancias con el contenido de ingrediente declarado por el proveedor (Figura 5 y Tabla 10). Por ejemplo, el prospecto de ingredientes indicaba que la tableta contenía 0,6 mg de retinol; sin embargo, no se pudo detectar ningún pico de retinol en la muestra, lo que significa que la cantidad debe ser inferior a 0,0002 mg / tableta. En cambio, el acetato de retinol se detectó a una concentración de 0,9 mg / tableta. En cambio, el acetato de retinol se detectó a una concentración de 0,9 mg/tableta, mientras que en el prospecto de ingredientes no se informa esta vitamina. En el prospecto, se informa acetato de a-tocoferole con una concentración de 10 mg / comprimido y a-tocoferole con 6,1 mg / comprimido. Los resultados cuantitativos de ambos analitos muestran un valor significativamente más alto para el acetato de a-tocoferol y un valor significativamente más bajo para el a-tocoferol. La filoquinona está muy de acuerdo con la cantidad indicada en la etiqueta y la medida.
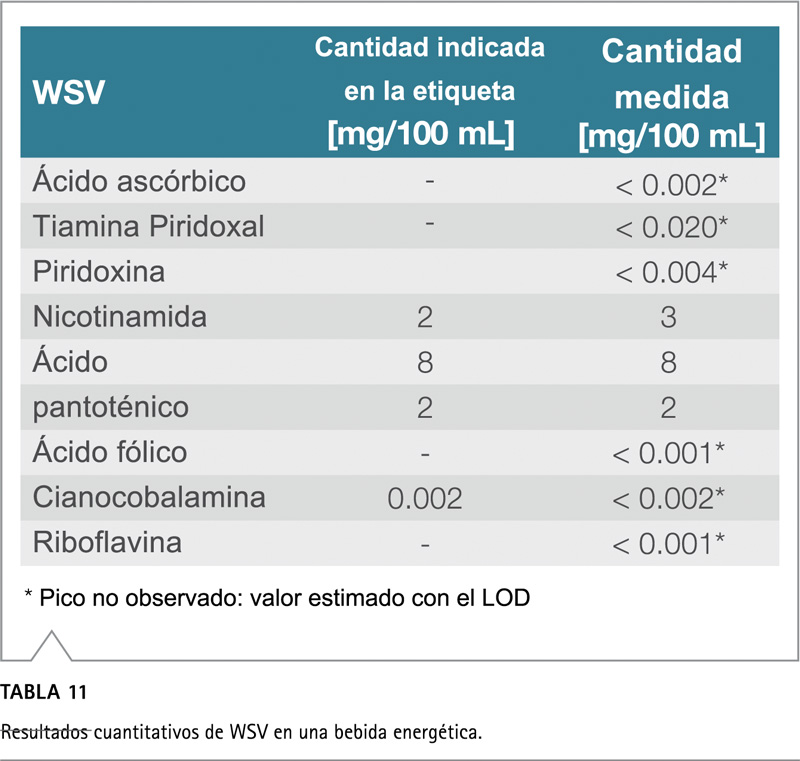
La bebida energética contiene solo cuatro de nueve WSV, a saber, piridoxina, nicotinamida, ácido pantoténico y cianocobalamina (Tabla 11). Las cantidades etiquetadas y calculadas muestran una excelente correspondencia. Nuevamente, la cianocobalamina se agrega en una concentración por debajo del límite de detección y, por lo tanto, no se puede cuantificar mediante este método.
Conclusión
Se describió un método basado en el sistema Vanquish Flex Duo para dos columnas LC Acclaim PA2 para el análisis cuantitativo de FSV y WSV en bebidas y tabletas de complementos alimenticios.
La configuración de trabajo presentada permite ejecutar dos métodos con columnas separados en un único instrumento, simultáneamente y sin equipo adicional. El enfoque proporciona ventajas sustanciales en términos de rendimiento y elimina problemas como la incompatibilidad de disolventes. Esta configuración de trabajo es notablemente fácil de configurar y operar, a diferencia de las soluciones reportadas anteriormente para el análisis imultáneo de vitaminas solubles en agua y grasas. La columna Acclaim PA2 demostró ser un caballo de batalla altamente confiable y eficiente para la separación de compuestos con una amplia gama de hidrofobicidad.
El análisis de la tableta del suplemento proporcionó cantidades de vitaminas generalmente más altas que las informadas en el prospecto de ingredientes. Además, se detectó y cuantificó el acetato de retinol a pesar de que el fabricante no incluyó este componente como ingrediente.
Para la bebida energética, las cantidades estimadas y declaradas coincidieron perfectamente.
Referencias
- Thermo Fisher Scientific Nota técnica 72488: Determinación de vitaminas solubles en agua y grasas por HPLC.
- Nota de aplicación 252 de Thermo Fisher Scientific: ensayo HPLC de vitaminas solubles en agua, vitaminas solubles en grasa y un conservante en la formulación multivitamínica de jarabe seco.
- Choi, C.K .; Dong, M.W. (2005) Preparación de muestras para análisis HPLC de productos farmacéuticos. En: Ahuja S, Dong MW (eds) Manual de análisis farmacéutico por HPLC, 1ª ed. Elsevier, Amsterdam, págs. 123–143.
Para uso exclusivo en investigación. No debe utilizarse en los procedimientos de diagnóstico.










