
Espectroscopía UV-Vis para la calidad del agua potable
Introducción
Garantizar que el agua potable esté libre de contaminantes no deseados es de suma importancia. Estos contaminantes no solo pueden alterar el sabor y la apariencia del agua, sino que también pueden generar problemas de salud pública. Por ello, algunas agencias gubernamentales, como la Agencia de Protección Ambiental de los Estados Unidos (EPA), han establecido requisitos para los niveles seguros de contaminantes comunes en fuentes de agua potable.
Estos contaminantes pueden abarcar desde materiales inorgánicos, como plomo o hierro, hasta compuestos orgánicos (p. ej., tetracloruro de carbono, glifosato, etc.) e incluyen una gran cantidad de sustancias que requieren identificación. Aunque existen numerosos materiales que deben ser monitoreados, también hay una amplia variedad de técnicas analíticas que se pueden utilizar para este análisis, una de las cuales es la espectroscopía de absorción UV-Visible.
Este método se basa en la capacidad de la luz UV-Visible para inducir transiciones entre el estado electrónico fundamental y el estado excitado dentro de un compuesto. Debido a que estas transiciones electrónicas son específicas del compuesto analizado, este método puede proporcionar información cualitativa y cuantitativa única sobre la sustancia medida. Al ser un método estrictamente basado en interacciones de la luz con la muestra, ofrece un análisis rápido y no destructivo.
En el caso de muestras de agua, un número significativo de procedimientos involucra el uso de indicadores colorimétricos como método de detección para analitos que no absorben fácilmente en la región UV-Visible. En estos métodos, la interacción entre el analito de interés y el reactivo colorimétrico produce un cambio de color en la solución, el cual puede observarse mediante espectroscopía de absorción UV-Visible. Según la ley de Beer

donde Aλ es la absorbancia medida, l es la longitud del trayecto de la cubeta, ελ es el coeficiente de extinción y c es la concentración del analito. La concentración es linealmente proporcional a la absorbancia. Por lo tanto, los análisis de absorción proporcionan una forma de cuantificar el contenido de analitos en una muestra.
En este documento, se utilizaron dos análisis colorimétricos para determinar el contenido total de cloro y hierro en muestras de agua de grifo, empleando el espectrofotómetro UV-Visible Thermo Scientific™ GENESYS™ 50. Estos análisis se llevaron a cabo utilizando métodos preconfigurados incluidos en el software GENESYS Water Analysis. Además, con soluciones estándar, se probaron los métodos preconfigurados para cloro total y hierro total para garantizar que las concentraciones reportadas fueran precisas.
Kits de análisis de agua
Para el análisis de cloro total y hierro total (Fe²⁺ y Fe³⁺) en muestras de agua, utilizando el software preconfigurado de análisis de agua UV-Visible, se emplearon los kits de análisis de agua Thermo Scientific™ Orion™ AC4P72 para cloro total y Thermo Scientific™ Orion™ AC4P78 para hierro (II y III). Ambos kits se utilizaron tal como se recibieron.
El kit de cloro total se basa en la reacción colorimétrica entre el cloro y el sulfato de N,N’-dietil-p-fenilendiamina (DPD), que provoca un cambio de color de incoloro a rosa. Por su parte, el kit de hierro utiliza la reacción entre la 1,10-fenantrolina y los iones Fe²⁺, lo que cambia el color de la solución de incoloro a rojo/naranja. Además, este kit incluye un agente reductor que convierte el Fe³⁺ residual en Fe²⁺, permitiendo determinar el contenido total de hierro.
Preparación de muestras: estándares de hierro
Para la prueba de análisis de hierro total, se prepararon soluciones estándar de Fe²⁺ para confirmar la precisión del método. Brevemente, se preparó una solución madre disolviendo 32,6 mg de sulfato de amonio y hierro(II) en 47,0 mL de agua desionizada (DI). Posteriormente, la solución se diluyó para obtener una solución de 10 mg/L de Fe²⁺.
También se prepararon estándares de Fe³⁺ para confirmar que el kit puede evaluar con precisión el contenido de hierro en ambos estados de oxidación. La solución madre estándar de Fe³⁺ se obtuvo disolviendo 42,7 mg de cloruro férrico en 10,0 mL de agua DI, diluyéndose posteriormente para generar una solución de 30 mg/L de Fe³⁺.
Se prepararon soluciones estándar de concentraciones conocidas de Fe²⁺ y Fe³⁺ diluyendo las respectivas soluciones madre con agua DI. Para ambos estados de oxidación del hierro, se generaron tres soluciones estándar (0,35 mg/L, 0,75 mg/L y 1,50 mg/L). A cada solución estándar se le agregó un paquete de polvo reactivo de hierro del kit AC4P78, y se dejó disolver completamente antes del análisis UV-Visible. Estas muestras se prepararon por triplicado.
Para el análisis de curva estándar, realizado sin utilizar el método preconfigurado de análisis de hierro, se generaron tres soluciones separadas:
- Solución madre de 1,10-fenantrolina (18 mM): Se disolvieron 32,5 mg de 1,10-fenantrolina en 10 mL de agua DI.
- Solución madre de acetato de sodio (1,0 M): Se disolvieron 820,6 mg de acetato de sodio en 10 mL de agua DI.
- Solución madre de hidrocloruro de hidroxilamina (0,30 M): Se disolvieron 205,8 mg de hidrocloruro de hidroxilamina en 10 mL de agua DI.
Las soluciones estándar y las muestras se prepararon según lo descrito en la Tabla 1.
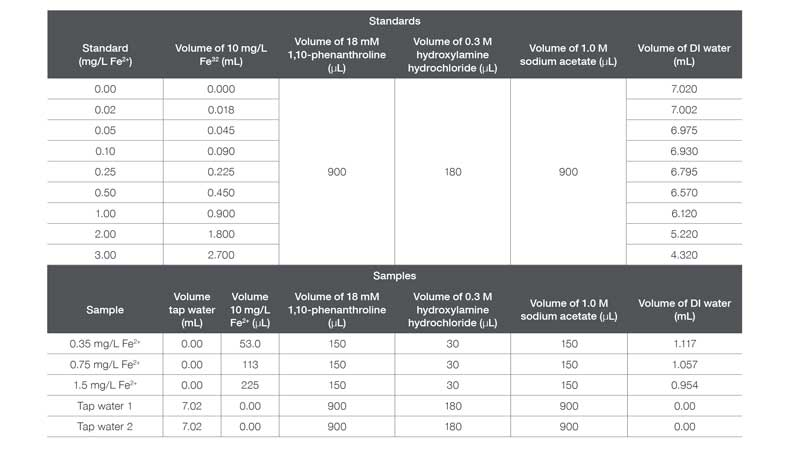
Preparación de estándares de Fe2+ y muestras para el análisis de curva estándar.
Preparación de muestras: estándares de cloro
Se generaron soluciones estándar de cloro para confirmar la validez del método preconfigurado utilizado para determinar el contenido total de cloro. Según el procedimiento del kit, se sabe que el reactivo DPD también reacciona con KMnO₄, lo que produce un cambio de color similar al observado en la reacción con cloro. El procedimiento del kit AC4P72 establece que la respuesta observada para una solución de 0,891 mg/L de KMnO₄ es equivalente a la respuesta de una solución de cloro de 1,00 mg/L. Por lo tanto, se utilizó KMnO₄ para confirmar la precisión del método de prueba.
Se preparó una solución madre de KMnO₄ de 1890 mg/L disolviendo 18,9 mg de KMnO₄ en 10 mL de agua desionizada (DI). Esta solución se diluyó posteriormente para obtener una solución de 10 mg/L de KMnO₄. Luego, se prepararon cuatro soluciones de KMnO₄ (0,089 mg/L, 0,22 mg/L, 0,67 mg/L y 1,34 mg/L) diluyendo la solución madre de 10 mg/L de KMnO₄ con la cantidad apropiada de agua DI.
La Tabla 2 detalla qué concentración de KMnO₄ corresponde a una concentración de cloro percibida, según la respuesta obtenida con el método de DPD. A 10 mL de cada muestra de KMnO₄, se le añadió un paquete del reactivo en polvo para cloro total del kit AC4P72 y se dejó disolver completamente. Este procedimiento se repitió para generar tres muestras independientes, que luego se analizaron utilizando espectroscopía UV-Visible, como se discutirá más adelante.
Para determinar el límite de detección (LOD) y el límite de cuantificación (LOQ) del análisis preconfigurado de cloro total, se prepararon siete muestras en blanco disolviendo un paquete del reactivo del kit en 10 mL de agua DI para cada réplica.
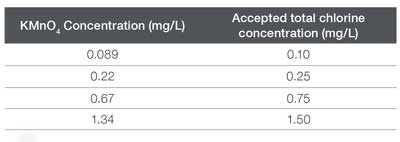
Concentraciones de KMnO4 y concentraciones correlacionadas de cloro.
Preparación de muestras: agua de grifo
Para demostrar el análisis de agua potable, se recolectaron muestras de agua de grifo de dos fuentes diferentes, que se utilizaron para los análisis de cloro y hierro mediante los métodos preconfigurados de análisis de agua. Como en los estándares descritos anteriormente, se añadió un paquete de reactivo en polvo, ya sea para cloro o para hierro, a 10 mL de cada muestra. Las soluciones se prepararon y midieron por triplicado.
Instrumentación
Todas las muestras se midieron utilizando un espectrofotómetro UV-Visible Thermo Scientific GENESYS 50. El software GENESYS Water Analysis se empleó para medir el contenido total de cloro y hierro, utilizando métodos preconfigurados de curvas estándar diseñados para el kit de cloro total (AC4P72) y el kit de hierro (II y III) (AC4P78). Según el protocolo, el instrumento estaba equipado con un soporte de tubos y se utilizó un vial de 24 mm de diámetro.
De acuerdo con la configuración de ambos métodos preconfigurados, se monitoreó la absorbancia a 510 nm y se utilizó la ecuación de curva estándar incorporada para convertir la absorbancia en concentración del analito. Para establecer el fondo de la medición, se disolvió el contenido de un paquete de reactivo en 10 mL de agua desionizada (DI), formando la solución en blanco. Todas las muestras y estándares se midieron por triplicado.
Para el método de curva estándar de hierro, se utilizó la aplicación Quant en el software de control local del espectrofotómetro GENESYS 50. La absorbancia de los estándares descritos en la Tabla 1 se midió a 510 nm para desarrollar la curva estándar. Posteriormente, se midieron también las muestras (Tabla 1) a 510 nm. Cada estándar y muestra se colocó en una cubeta de cuarzo de 10 mm y se midió por triplicado. El agua DI se utilizó como blanco.
Las mediciones de escaneo se realizaron utilizando la aplicación Scan en el espectrofotómetro GENESYS 50 UV-Visible. Los espectros de absorción se midieron entre 325 y 1100 nm con una velocidad de escaneo lenta y un paso de 1.0 nm. Las muestras se colocaron en un vial de 24 mm de diámetro, utilizando nuevamente agua DI como blanco.
Resultados y discusión
Análisis de hierro
La presencia de hierro en el agua potable puede alterar su sabor y causar decoloración. Aunque no representa un problema de salud significativo, es útil realizar pruebas para fines estéticos (sabor y olor) y para detectar corrosión en la maquinaria de las instalaciones. Por esta razón, la EPA de los Estados Unidos ha establecido estándares secundarios para el agua potable, incluyendo el hierro, que aunque no representan riesgos importantes para la salud, son relevantes por razones estéticas.
Existen varios métodos para la cuantificación de hierro en el agua, incluido el uso de la reacción entre la 1,10-fenantrolina y los iones Fe²⁺ como indicador colorimétrico. En este método, una muestra de agua incolora se torna naranja en presencia de iones Fe²⁺ debido a la formación de ferroína, un complejo de coordinación compuesto por tres moléculas de 1,10-fenantrolina y un ion Fe²⁺ (Figura 1a). Frecuentemente, se utiliza un agente reductor como el hidroxilamina para asegurar la conversión de Fe³⁺ en Fe²⁺ antes del análisis.
El hidrocloruro también se utiliza para convertir los iones residuales de Fe³⁺ en Fe²⁺, permitiendo la detección de ambos estados de oxidación del hierro. Aunque esta reacción es útil como inspección visual para la detección de hierro, la solución resultante puede analizarse posteriormente mediante espectroscopía de absorción UV-Visible para cuantificar el contenido de hierro.
La Figura 1b muestra los espectros de absorción UV-Visible de los reactivos de análisis de agua (kit AC4P78) con y sin sulfato de amonio y hierro(II). Sin la presencia de iones Fe²⁺, el espectro de absorción presenta únicamente un inicio de absorción alrededor de ~400 nm, con una cola que se extiende hasta ~550 nm. Sin embargo, cuando los iones Fe²⁺ están presentes, el complejo de ferroína resultante genera una característica de absorción con máximos en ~480 nm y ~510 nm.
En los experimentos descritos en este documento, la absorbancia medida a 510 nm se utilizará para determinar el contenido de hierro.
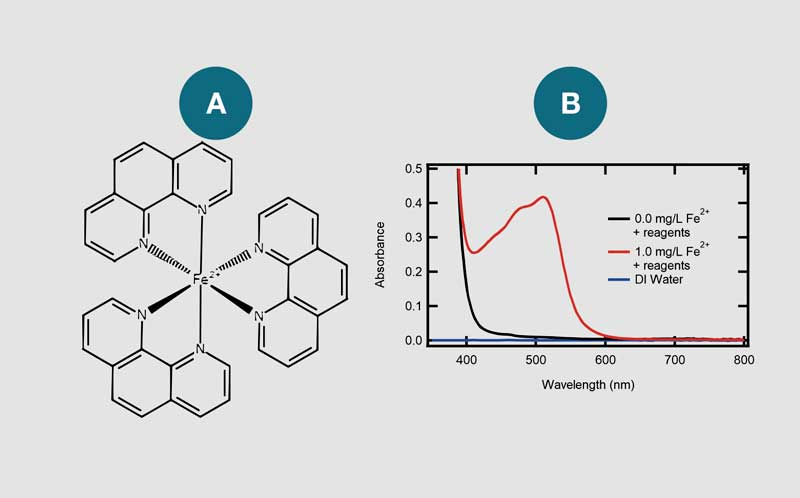
(a) Estructura del complejo entre Fe²⁺ y 1,10-fenantrolina.
(b) Espectros UV-Visible de los reactivos de hierro disueltos en agua desionizada (línea negra) y una solución acuosa de Fe²⁺ de 1.0 mg/L (línea roja). Los espectros se recolectaron en un vial de 24 mm de diámetro.
Tradicionalmente, se preparan muestras con diferentes concentraciones de hierro y se mezclan con la misma cantidad del reactivo colorimétrico para construir una curva de calibración (también llamada curva estándar). Se mide la absorbancia de cada muestra a una longitud de onda específica, en este caso 510 nm para el análisis de hierro, y se grafica como función de la concentración de hierro. La ley de Beer (Ecuación 1) indica que la relación entre la absorbancia medida y la concentración del analito es lineal. Por lo tanto, la curva estándar se ajusta a una función lineal que representa esta relación y se utiliza para calcular la concentración del analito en una muestra “desconocida”.
Sin embargo, el software GENESYS Water Analysis ya incluye las funciones lineales necesarias para los métodos que requieren una curva estándar. Aunque construir una curva estándar al inicio del experimento es una buena práctica de laboratorio, la inclusión de estas curvas preconfiguradas en el software reduce el tiempo necesario para analizar una muestra.
Para evaluar la precisión del método preconfigurado de análisis de hierro, se analizaron tres estándares de Fe²⁺ con concentraciones variables (0.35, 0.75 y 1.5 mg/L) utilizando el método “AC4P78, Iron, II & III” del software GENESYS Water Analysis. La Tabla 3 muestra la absorbancia medida y las concentraciones calculadas según el método preconfigurado. Se calculó el porcentaje de diferencia respecto a la concentración esperada utilizando la Ecuación 2 para mostrar la proximidad de los valores a la concentración aceptada:
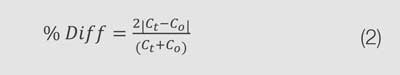
En esta ecuación, Ct es la concentración verdadera del analito y Co es la concentración observada. Los resultados indican que el método de análisis de hierro del software GENESYS Water Analysis pudo producir concentraciones calculadas con una diferencia porcentual respecto a la concentración verdadera inferior al 5%.
Como punto de comparación, se construyó una curva estándar utilizando un conjunto separado de estándares preparados sin los reactivos del kit (ver la sección Experimental para más detalles). Las muestras con las mismas concentraciones de Fe²⁺ (0.35, 0.75 y 1.5 mg/L) se analizaron utilizando esta curva estándar construida manualmente (Figura 2), y los valores de Fe²⁺ se reportaron en la Tabla 3. Como se explicó anteriormente, esta curva estándar no utiliza los reactivos colorimétricos del kit de análisis de hierro AC4P78, pero se construyó utilizando la misma reacción colorimétrica entre Fe²⁺ y 1,10-fenantrolina.
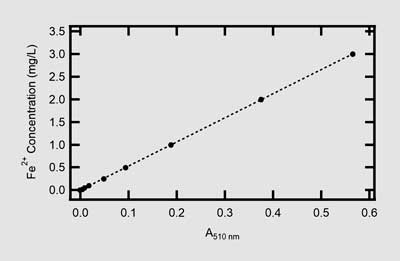
Curva estándar construida manualmente para el análisis del contenido de hierro en presencia de 1,10-fenantrolina.
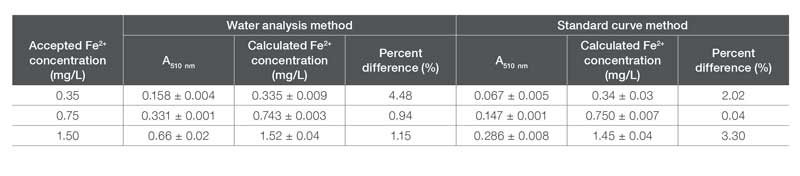
Absorbancia, concentración calculada de Fe y diferencias porcentuales asociadas para soluciones estándar de Fe²⁺, utilizando tanto el método del software GENESYS Water Analysis como el método de curva estándar para soluciones estándar de Fe²⁺.
Como se muestra en la Tabla 3, el método de curva estándar también pudo determinar con precisión la concentración de Fe2+ en cada muestra, con valores de diferencia porcentual también por debajo del 5%. Cabe destacar que las absorbancias para cada concentración de muestra no coinciden entre los métodos de análisis. Esta diferencia se explica fácilmente por el uso de contenedores de muestra de diferente tamaño: dado que el kit requiere el uso de un vial de 24 mm y la curva estándar se construyó utilizando una cubeta de cuarzo de 10 mm, se espera una absorbancia más baja para este último método según la ley de Beer (Ecuación 1). Los resultados incluidos en la Tabla 3 indican que, aunque lo mejor es construir manualmente una curva estándar, este método preconfigurado de hierro es preciso dentro del rango de concentración descrito y se puede utilizar fácilmente en lugar de una curva estándar construida manualmente.
En el método de 1,10-fenantrolina, a menudo se requiere un agente reductor para convertir los iones Fe3+ libres en Fe2+, ya que el primer ion no puede formar ferroína, el complejo monitoreado en este ensayo colorimétrico. Para garantizar que los reactivos en el kit AC4P78 pudieran reducir adecuadamente el Fe3+ a Fe2+, se prepararon y analizaron tres muestras con concentraciones conocidas de Fe3+ (0,35, 0,75 y 1,5 mg/L) de acuerdo con las instrucciones del kit. Las mediciones de absorbancia se recopilaron utilizando el método “AC4P78, Hierro, II & III” en el software de análisis de agua GENESYS. La Tabla 4 incluye la absorbancia medida y la concentración calculada para cada muestra de Fe3+. Al igual que con los resultados de Fe2+, la diferencia porcentual es <5%, lo que sugiere que el método preconfigurado y el kit asociado funcionan bien para las muestras de Fe3+ dentro del rango de concentración especificado.
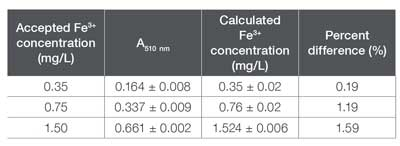
Absorbancia, concentraciones calculadas de Fe y diferencias porcentuales asociadas para soluciones estándar de Fe3+ analizadas utilizando tanto el software GENESYS Water Analysis como los métodos de curva estándar.
Para muestras más realistas, se recogieron y probaron dos muestras separadas de agua potable utilizando tanto el método preconfigurado de análisis de agua como los métodos de curva estándar descritos previamente. Se espera que estas muestras no contengan una gran concentración de hierro, aunque reflejarán una matriz de muestra que contiene más de un analito. La absorbancia medida a 510 nm para ambas muestras (Tabla 5) estuvo muy por debajo del nivel de ruido del espectrofotómetro GENESYS 50 y, por lo tanto, por debajo del límite de detección. Por lo tanto, si el hierro está presente en estas muestras, está en cantidades tan bajas que no se puede detectar mediante ninguna de estas técnicas UV-Visibles. Según las pautas de la EPA sobre estándares secundarios, el contenido de hierro aceptable debe ser < 0.3 mg/L. Como se esperaba, el agua potable analizada cumple con este requisito.
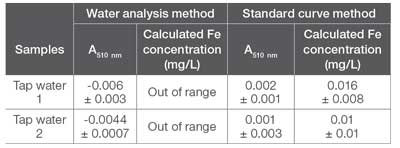
Measured absorbance and calculated iron concentration for tap water samples.
Análisis de cloro
Mientras que el contenido de hierro está más relacionado con la apariencia y el sabor del agua potable, existen otros contaminantes que pueden representar un riesgo para la salud pública. Por ejemplo, el crecimiento de bacterias puede ser una preocupación para el agua potable. Para evitar esto, se utilizan desinfectantes para prevenir el crecimiento de bacterias o eliminar las colonias ya formadas. Estos desinfectantes suelen incluir cloro y/o cloramina. Si bien esto elimina el riesgo de crecimiento bacteriano, el exceso de estos desinfectantes también puede ser perjudicial. En consecuencia, es importante conocer la cantidad de cloro presente para asegurarse de que no supere los niveles seguros.
Un método comúnmente utilizado para determinar el contenido de cloro emplea la espectroscopía de absorción UV-Visible. Este método, en el que se basa el kit de análisis de agua Orion AC4P72, utiliza la reacción entre el sulfato de N,N-dietil-p-fenilendiamina (DPD) y el cloro libre. El producto resultante cambia el color de la solución de incoloro a rosa, produciendo máximos de absorción a 475 nm, 511 nm y 553 nm, como se muestra en la Figura 3. Para muestras que también contienen cloramina, se usa yoduro de potasio para reaccionar con la cloramina. Esto produce un compuesto que puede reaccionar adicionalmente con el DPD residual. Al monitorear la absorbancia a 510 nm en función de la concentración de cloro, se puede desarrollar una curva estándar, proporcionando un método para cuantificar el contenido de cloro libre presente. El software GENESYS Water Analysis incluye métodos preconfigurados para el análisis colorimétrico de DPD para cloro libre, como el kit utilizado en los experimentos descritos aquí (AC4P72).
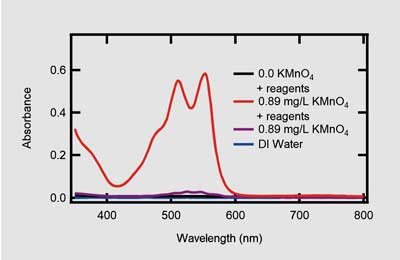
Espectros de absorción UV-Visible de los reactivos para el análisis de cloro disueltos en agua (negro), 0.89 mg/L de KMnO4 (morado) y 0.89 mg/L de KMnO4 en presencia de reactivos de análisis de cloro disueltos (rojo). Todas las muestras fueron mantenidas en un frasco de 24 mm de diámetro.
Para evaluar la precisión del método preconfigurado de cloro libre, se preparó y analizó un conjunto de cuatro estándares con concentraciones variables utilizando el método “AC4P72”. Dado que las soluciones de cloro son a menudo inestables y pueden degradarse con el tiempo, debe usarse un estándar secundario para evaluar el método preconfigurado. Como se describió anteriormente, el KMnO₄ también puede reaccionar con el DPD de manera similar al cloro y, por lo tanto, se utiliza comúnmente como un estándar para este procedimiento. En este caso, se utilizaron un conjunto de estándares de KMnO₄ (0.089, 0.22, 0.67 y 1.34 mg/L) para verificar la precisión del software de análisis de agua GENESYS.
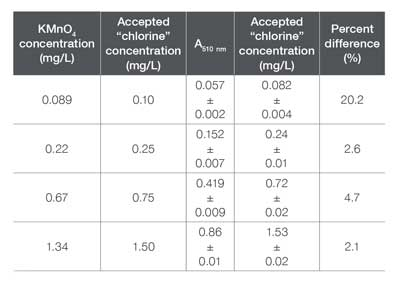
Concentración calculada de Cl₂ de soluciones estándar. También se incluye la diferencia porcentual.
La Tabla 6 incluye la concentración de cloro calculada para cada muestra de KMnO₄ medida, así como la concentración esperada de cloro. La diferencia porcentual para cada muestra, con excepción de la muestra de menor concentración, está por debajo del 5%, lo que sugiere que estos valores son precisos. La diferencia del 20% calculada para la muestra de 0.089 mg/L de KMnO₄ implica que la muestra no fue preparada correctamente o que esta concentración podría estar por debajo del límite de cuantificación (LOQ) y/o del límite de detección (LOD).

El LOD y el LOQ son dos valores separados para evaluar la fiabilidad de las mediciones de muestras con baja concentración de analito. El LOD define la menor cantidad medible que se puede distinguir del blanco (es decir, la menor absorbancia). El blanco hace referencia a la muestra sin analito, pero que contiene los reactivos colorimétricos. Este valor puede calcularse usando la desviación estándar de la respuesta (es decir, la absorbancia) medida para las soluciones en blanco replicadas, así como el promedio de las mediciones del blanco. La Ecuación 3 incluye el cálculo del LOD a través de este método:
donde xb es la absorbancia promedio de las muestras en blanco, sb es la desviación estándar del blanco.
Alternativamente, si los datos se ajustan a una función lineal, el límite de detección se puede calcular usando la pendiente de la línea y el error estándar de la estimación, como se muestra en la Ecuación 4:
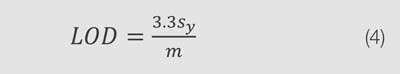
donde sy es el error estándar de la estimación, y mm es la pendiente de la curva lineal. Sin embargo, como los métodos preconfigurados no proporcionan estos datos, se puede usar la Ecuación 3 en su lugar.
Para el análisis de cloro total utilizado previamente, se midieron siete soluciones en blanco utilizando el método preconfigurado de cloro total. Usando la desviación estándar y el promedio de la absorbancia recolectada para estas muestras en blanco, se encontró que el LOD era 0.018 A, lo que corresponde a una concentración de 0.014 mg/L. Cabe señalar que el LOD puede usarse para definir el punto en el cual un método y/o instrumento es capaz de determinar la presencia de un analito, pero el LOQ define la respuesta más baja que se puede utilizar para la cuantificación y puede calcularse como se muestra en la Ecuación 5:

Para el método de cloro total, el LOQ fue encontrado como 0.041 A, lo que se correlaciona con una concentración de 0.053 mg/L. Para la muestra de concentración más baja estudiada aquí (0.089 mg/L KMnO₄, correspondiente a una concentración de cloro de 0.1 mg/L), la absorbancia medida está por encima del LOD y el LOQ calculados, lo que sugiere que esta muestra puede haber sido preparada incorrectamente.
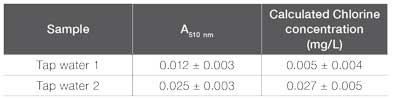
Concentración calculada de Cl₂ de muestras de agua de grifo.
De manera similar al análisis de hierro descrito previamente, se probaron dos muestras de agua de grifo para determinar el contenido de cloro total utilizando el método de cloro total en el software GENESYS Water Analysis (Tabla 7). La muestra de agua de grifo 1 dio una absorbancia reportada de 0.012 ± 0.003 A. Como se describió anteriormente, el LOD para este análisis es 0.018 A, lo que indica que este método no pudo detectar el cloro presente en la muestra. Con esta información, se puede concluir que el contenido de cloro presente en esta muestra está por debajo del límite aceptable de 4.0 mg/L. La segunda muestra de agua de grifo tuvo una absorbancia medida notablemente más alta a través de este método (0.025 ± 0.003 A). Dado que esta concentración está por encima del LOD, se puede determinar que se detectó cloro en la muestra, sin embargo, esta absorbancia está por debajo del LOQ. En consecuencia, la concentración de cloro total debe reportarse como <0.053 mg/L. Al igual que la muestra de agua de grifo 1, la muestra de agua de grifo 2 también está por debajo de los límites aceptables para el contenido de cloro total en agua potable, como se esperaba.
Conclusiones
Aunque los ensayos colorimétricos proporcionan un método indirecto para analizar el contenido de hierro y cloro en muestras de agua, los experimentos detallados en este estudio destacan la precisión de las técnicas de absorción UV-Visible, incluso en concentraciones bajas de analito. Estos resultados también detallan la fiabilidad de los métodos preconfigurados de análisis de agua GENESYS para la determinación cuantitativa de sustancias comunes encontradas en el agua potable. Además, el análisis de dos muestras de agua demostró que el agua estaba por debajo de los niveles designados por la EPA para cloro y hierro, como se esperaba, lo que demuestra aún más la capacidad de utilizar esta técnica rápida y no destructiva para el análisis de agua potable.
Referencias
- Drinking Water Requirements for States and Public Water Systems – Drinking Water Regulations, https://www.epa.gov/dwreginfo/drinking-water-regulations (accessed 2024-09-13).
- Moberg, L.; Karlberg, B., An Improved N,N’-diethyl-p-phenylenediamine (DPD) Method for the Determination of Free Chlorine Based on Multiple Wavelength Detection, Anal. Chim. Acta, 2000, 407, 127 – 133.
- Wang, G.; Xie, S., Water Quality Determination by Electrically Controlled DPD Spectrophotometry Method Research, J. Phys. Conf. Ser., 2021, 2033, 012106.
- Secondary Drinking Water Standards: Guidance for Nuisance Chemicals, https:// www.epa.gov/sdwa/secondary-drinking-water-standards-guidance-nuisancechemicals (accessed 2024-09-13).
- Smith, G.L.; Reutovich, A.A.; Srivastava, A.K.; Reichard, R.E.; Welsh, C.H.; Melman, A.; and Bou-Abdallah, F., Complexation of Ferrous Ions by Ferrozine, 2,2’-bipyridine and 1,10-phenanthroline: Implication for the Quantification of Iron in Biological Systems, J. Inorg. Biochem., 2021, 220, 111460.
- Herrera, L.; Ruiz, P.; Aguillon, J. C.; Fehrmann, A., A New Spectrophotometric Method for the Determination of Ferrous Iron in the Presence of Ferric Iron, J. Chem. Tech. Biotechnol., 1989, 44, 171 – 181.
- Chernysh, V. V.; Kononets, M. Y.; Proshurnin, M. A.; Pakhomova, S. V.; Komissarov, V. V.; Zatsman, A. I., Thermal Lens Studies of the Reaction of Iron (II) with 1,10-phenanthroline, at the Nanogram Level, Fresenius J. Anal. Chem., 2001, 369, 535 – 542.
- Busch, M. A.; Busch, K. W., Bleaches and Sterilants. In Encyclopedia of Analytical Science, 2nd ed.; Elsevier, 2005; pp 284 – 294
- United States Environmental Protection Agency, Office of Ground Water and Drinking Water, Stage 1 Disinfectants and Disinfection Byproducts Rule [EPA 816-F-01-014], 2001, https://nepis.epa.gov/Exe/ZyPDF.cgi?Dockey=P1009Q0H. txt (accessed 2024-08-14).
- Standard Methods for the Examination of Water and Wastewater, 23rd ed.; Baird, R. B.; Eaton, A. D.; Rice, E. W., Eds; American Public Health Association, 2017.
- Evard, H.; Kruve, A.; Leito, I., Tutorial on Estimating the Limit of Detection Using LC-MS Analysis, Part I: Theoretical Review, Anal. Chim. Acta, 2016, 942, 23 – 39.
Tambien le puede interesar:
Guía para la identificación de microplásticos por espectroscopía FTIR y Raman













