Buenas prácticas de laboratorio ¿En qué consisten?

Buenas prácticas de laboratorio. ¿En qué consisten?
Ina Kanngiesser.
Jefa de producto del departamento de Simulación Medioambiental
de BINDER GmbH
Hoy en día aún son visibles las consecuencias del escándalo del Contergan[1], por lo que la siguiente generación también debería de conocer lo que ocurrió. Los afectados siguen teniendo que luchar no solo contra los efectos directos, sino también contra lesiones derivadas como el elevado desgaste de las articulaciones debido a las malformaciones. Las “Buenas prácticas de laboratorio”, abreviado BPL, deben servir para evitar un nuevo escándalo dada su aplicación a nivel mundial. Como sistema de control de calidad, recoge todas las estructuras organizativas y procesos de análisis y ensayo para la autorización de comercialización de un medicamento. En el ámbito de las BPL resulta especialmente importante la seguridad frente a la manipulación de datos primarios, ya que dicha manipulación favorecería o aceleraría el proceso de autorización de comercialización. De este modo se podría intentar que el tiempo de trabajo y el coste de los estudios “no clínicos” no fueran en vano.
Por este motivo, las BPL no solo regulan los requisitos relativos al personal, las salas y los equipos, sino también las responsabilidades durante y después de la prueba. Se aplica el principio de supervisión múltiple, por lo que son necesarias varias firmas en los documentos de autorización. La evaluación científica solo tiene lugar en el proceso de autorización de comercialización.
Por ello, es necesario presentar todos los documentos. Si los documentos están incompletos, la autorización se retrasará o no se concederá, puesto que si en este punto falta documentación sobre análisis o pruebas se considerará que estos no se han realizado. Por todo lo anterior, es especialmente importante presentar todos los documentos para que pueda concederse una autorización de comercialización.
Introducción a las “Buenas prácticas de laboratorio”
La ley sobre “Buenas prácticas de laboratorio”, abreviadas como BPL, fue introducida en 1978 después de que la FDA (U.S. Food and Drug Administration) detectase graves deficiencias en los estudios toxicológicos de años anteriores. No se escatimaban esfuerzos para lograr por todos los medios la autorización de comercialización de un medicamento, a fin de que el largo tiempo de desarrollo y los costes no fueran en vano. El ejemplo de error más conocido en los estudios toxicológicos es el escándalo del Contergan, cuyas dimensiones siguen sin estar claras, razón por la que no ha sido posible estimar qué consecuencias han tenido en los afectados las cargas incorrectas en otras articulaciones y elementos de apoyo.
Por ese motivo era preciso crear un sistema de control de calidad que se ocupase del proceso organizativo y de las condiciones generales de las pruebas de seguridad no clínicas. Como pruebas no clínicas se entienden todos los ensayos de laboratorio que no se realizan en seres humanos. Además, solo determinados materiales están sujetos a las BPL, los denominados materiales “regulados” como, por ejemplo, medicamentos, productos fitosanitarios y sustancias químicas. Particularmente durante el desarrollo de medicamentos, las pruebas ecotoxicológicas, así como los ensayos toxicológicos y farmacológicos deben llevarse a cabo en conformidad con los principios BPL. Resumiendo, podría decirse que las BPL básicamente han de aplicarse cuando debe elaborarse la documentación para la autorización de comercialización.
Las BPL se introdujeron en todo el mundo con el objetivo de garantizar la fiabilidad de los datos y, por supuesto, el reconocimiento internacional de estos. A este respecto se valoran especialmente la transparencia, la trazabilidad, la asignación de responsabilidades y el mantenimiento de registros. La evaluación científica solo se lleva a cabo durante el proceso de autorización. Por consiguiente, las BPL regulan los requisitos relativos al personal y a las salas, así como otros requisitos organizativos como, por ejemplo, la infraestructura del centro de pruebas. Asimismo, este sistema de control de calidad también aborda el tema de la planificación y la realización de pruebas BPL.
Organización
3.1 Organización del personal
Es preciso un cierto coste de personal para organizar las BPL y poder garantizar la seguridad y el cumplimiento. Esta organización del personal no depende de la jerarquía de las empresas o institutos.
Una instalación como un centro de pruebas, que desee realizar ensayos siguiendo las BPL debe
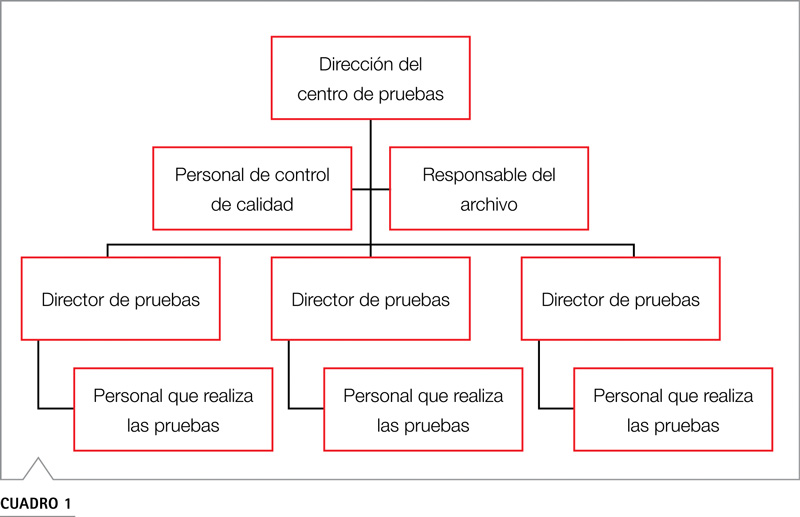
La dirección del centro de pruebas asume la responsabilidad (total) de la organización y del funcionamiento del centro, así como del presupuesto. Además, la dirección es responsable de cumplir los principios de las BPL en el centro de pruebas.
El director de pruebas se hace cargo de la dirección de la prueba de BPL correspondiente y asume la responsabilidad de la conformidad de la prueba con los principios de las BPL. Esto incluye, sobre todo, la elaboración y presentación de informes. El personal que realiza las pruebas también es responsable de la calidad y fiabilidad de los datos. Por ello, debe prestarse especial atención al correcto registro de los datos primarios, que ha de realizarse de forma inmediata y precisa.
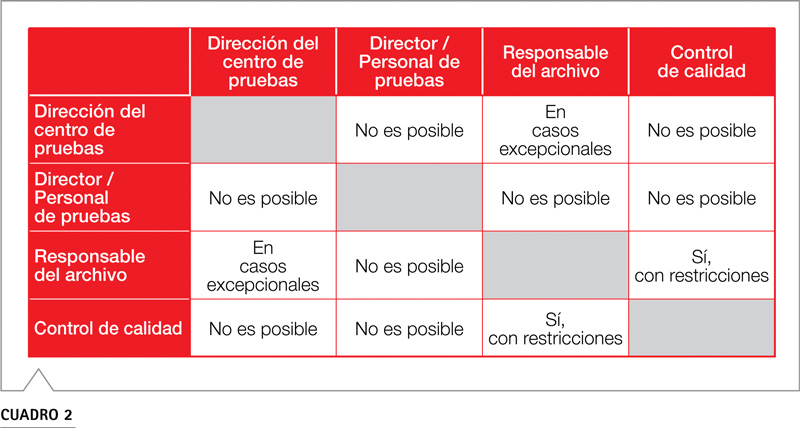
Con respecto a los responsables del archivo y al personal de control de calidad, es preciso señalar que no les está permitido participar en las pruebas BPL para garantizar una cierta independencia. Estas tareas pueden externalizarse. Esto representa un aumento considerable de los gastos de personal, algo que ya está causando problemas para cubrir todos los puestos en los institutos más pequeños. Además, debe plantearse un procedimiento de sustitución, por lo que se necesita personal adicional.
Con el fin de apoyar a los centros más pequeños, una sola persona puede asumir diversas responsabilidades, de tal modo que al final se produzca un gasto de personal de solo 2 personas si se traspasa la responsabilidad de los archivos y el control de calidad a una empresa externa. Estas dos personas se encargarían de la dirección del centro de pruebas y de la dirección de las pruebas.
Pero ¿dónde es posible una “unión de personal”?
Además, deben almacenarse determinados datos personales como, por ejemplo, la carrera profesional, la descripción de las tareas y las formaciones regulares con certificado. Estos documentos deberán actualizarse periódicamente y se encontrarán siempre en su versión más reciente.
3.2 Salas y equipos
Sin embargo, no solo existen requisitos relativos al personal, sino también sobre las salas y los equipos. Así, deben identificarse las áreas de BPL y separarse del resto de áreas. Esta separación empieza con el almacenamiento de las provisiones de animales de laboratorio, y afecta al mantenimiento de dichos animales y de las propias salas del laboratorio. También existen determinados requisitos para los equipos utilizados, especialmente los sistemas informáticos. Por ello, ha de garantizarse en todo momento su correcto funcionamiento, lo que puede hacerse mediante una supervisión, limpieza, mantenimiento y calibración periódicos.
Además, con los equipos utilizados en las BPL deben implantarse cuadernos diarios para registrar su uso y las pruebas de funcionamiento. Asimismo, es preciso facilitar un manual de instrucciones acorde, así como la documentación de mantenimiento y reparaciones. Los sistemas informáticos también deben ser desarrollados, validados, operados y sometidos a mantenimiento según los principios de BPL. Igualmente, debe existir un control de acceso, ya sea mediante una protección de acceso física o lógica (protegida por contraseña). Especialmente en la validación debe cumplirse otro estándar internacional: la guía GAMP 5.
Los centros de pruebas pueden ahorrar mucho dinero en lo que respecta a los sistemas informáticos adquiriendo equipos que ya cumplan las BPL. Por eso, la empresa BINDER GmbH ofrece un software especial para sus cámaras de simulación que ya cumple los requisitos de las BPL y, por consiguiente, también fabrica la totalidad de la cámara de simulación de conformidad con ellos. Esto supone una reducción del trabajo del centro de pruebas y la cámara de simulación puede utilizarse fácilmente para una prueba BPL.
Por otra parte, también se contemplan condiciones especiales para el archivo como, por ejemplo, un estricto control del acceso para que solo los responsables del archivo y sus sustitutos tengan permisos de acceso. No obstante, siempre podrá entrar otra persona al archivo como acompañante. Este estricto control pretende evitar que se manipulen los documentos. Actualmente, el periodo de archivado es de 15 años como mínimo, de modo que el tamaño del archivo debe elegirse según la cantidad de pruebas BPL.
3.3 Objetos de prueba y de referencia
En los trabajos de laboratorio resulta fundamental que todos los reactivos estén debidamente identificados y que incluyan una indicación sobre su durabilidad y la fecha de apertura. Además, deben presentar también las indicaciones de seguridad y los símbolos de peligro. Si se supera el periodo de durabilidad, es preciso deshacerse del objeto de prueba.
Alternativamente, una persona cualificada puede alargar la fecha de caducidad si lo documenta adecuadamente en el objeto con un aviso. Esta prolongación puede realizarse previa realización de un análisis en el que se documente todo con detalle.
Procedimientos operativos
Con las BPL se trabaja según el procedimiento operativo estándar que debe facilitarse en todos los lugares de trabajo. En este procedimiento se describen las actividades generales que son relevantes para las BPL. Cada centro de pruebas establece su propio procedimiento operativo, que debe supervisarse y actualizarse periódicamente. En dicho procedimiento operativo estándar (Standard Operating Procedure) se establecen determinados requisitos según las BPL. Por esta razón, en cada lugar de trabajo debe facilitarse un procedimiento operativo por escrito en su versión más reciente. Dicho procedimiento debe describir y fijar las tareas relevantes relacionados con las BPL.
El procedimiento operativo debe redactarse específicamente para cada centro de pruebas y debe tratarse de manera confidencial. Existen documentos que, si bien pueden utilizarse, deben ser adaptados correspondientemente y ser autorizados por la dirección del centro de pruebas. Por o tanto, un procedimiento operativo estándar es vinculante para el personal que realiza las pruebas.
Este procedimiento debe cubrir al menos 8 áreas para no causar retrasos en la autorización de comercialización.
- Objetos de ensayo y de referencia
- Equipos, materiales y reactivos
- Realización de registros, presentación de informes, mantenimiento de registros y recuperación.
- Sistemas de prueba (biológicos)
- Métodos de control de calidad
- Procedimiento en los métodos de pruebas y análisis
- Sistemas informáticos
- En su caso, “interfaces” con instituciones internas y externas
Una vez elaborado un procedimiento de prueba estándar, este debe ser firmado por el autor y el examinador. A continuación, ha de ser autorizado por Control de calidad y, por último, revisado por el director del centro de pruebas. El documento solo puede ser distribuido cuando incluya estas cuatro firmas.
Proceso de una prueba BPL
Como preparación para una prueba BPL, es preciso nombrar primero un director de pruebas que elaborará seguidamente un protocolo de pruebas. El protocolo de pruebas debe presentarse antes de comenzar el trabajo experimental específico de la prueba y ha de ser autorizado por el director del centro de pruebas, el departamento de control de calidad y el cliente. A partir de ese momento pueden empezar las pruebas.
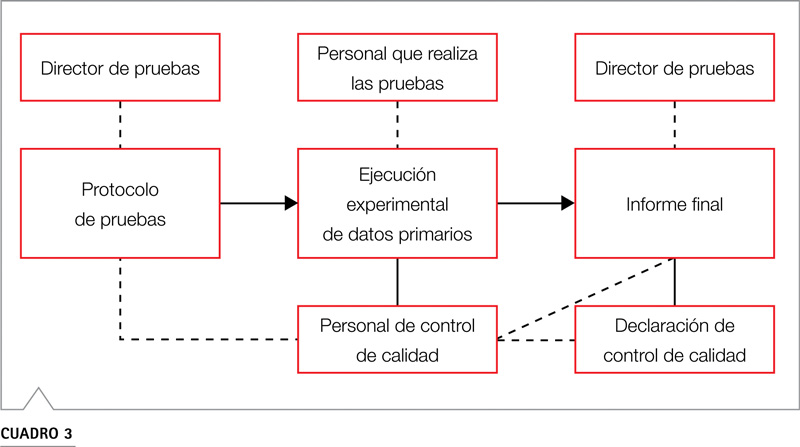
El protocolo de pruebas incluye la descripción cronológica del proceso de prueba, así como los métodos de ensayo y la frecuencia de ejecución. Estas tareas son vinculantes tras la autorización del protocolo de pruebas y solo está permitido modificarlas en casos excepcionales. Toda modificación ha de ser debidamente documentada mediante un anexo al protocolo de pruebas. Aquí se diferencia entre u modificaciones del protocolo de pruebas, necesarias en caso de anexos, enmiendas, actualizaciones o correcciones de los datos, y u desviaciones del protocolo de pruebas, necesarias en caso de acontecimientos imprevisibles, averías o errores humanos.
La prueba BPL debe realizarse siguiendo el protocolo de pruebas y documentarse debidamente. Durante el proceso de documentación ha de comprobarse que esta sea completa, directa y precisa y que pueda asignarse en cualquier momento de la prueba. Además, todos los datos del examinador deben identificarse con abreviatura y fecha y no está permitida su posterior modificación. De este modo, se pretende garantizar la transparencia de los datos durante toda la prueba y una vez finalizada la misma. Igualmente, pueden establecerse inspecciones de control de calidad con las que se compruebe el cumplimiento de los principios de las BPL. Una vez finalizada una prueba BPL se concluye con el informe final. Incluso en caso de interrupción de las pruebas, es necesario presentar al menos un breve informe. Este informe debe ser elaborado por el director de la prueba y ser autorizado posteriormente por el departamento de control de calidad, que lo completa con una declaración y con los resultados de la inspección.
Autorización
La autorización de comercialización puede concederse en cuanto se presenten todos los documentos, se documenten y archiven. Solo entonces se lleva a cabo una evaluación científica de la prueba. Durante la autorización de comercialización rige la máxima de que todo lo que no esté documentado no ha sido realizado. Si faltan documentos puede no autorizarse un producto y por lo tanto, se perdería el trabajo, tiempo y dinero de varios años.
Este sistema de control de calidad debe servir para que no se concedan autorizaciones apresuradas en las que no se consideren todas las posibilidades. Mediante las BPL se establece un estándar mundial que impide la manipulación y, por consiguiente, unifica el procedimiento de autorización de comercialización independientemente de dónde se desarrolle el medicamento.