Dispositivo para isoelectroenfoque con tiras de gel de IPG

Dispositivo para isoelectroenfoque con tiras de gel de IPG
Durante más de 30 años, los investigadores de todo el mundo han empleado la electroforesis bidimensional para separar las proteínas de acuerdo con su carga y tamaño. La electroforesis bidimensional se ha convertido en una técnica ampliamente utilizada en el campo de la proteómica para el estudio de la expresión de las proteínas y su identificación en mezclas complejas. Esta técnica consiste en la separación de una muestra proteica a través de dos métodos diferentes de electroforesis.
La metodología actual consiste en la separación de las proteínas en tiras de gel mediante isoelectroenfoque (IEF), que se basa en el punto isoeléctrico (pI) de las proteínas bajo condiciones reducidas y desnaturalizantes (primera dimensión), seguida de la separación en gel plano basado en masa proteica (segunda dimensión). La técnica combinada transforma las proteínas en manchas. Las proteínas se detectan mediante su rotulación previa o mediante la tinción del gel después de la electroforesis. Se obtienen las imágenes de los geles, que se cuantifican para detectar las diferencias en los patrones bidimensionales resultantes. También es posible extraer las manchas individuales de la proteína del gel e identificarlas mediante espectrometría de masas o secuenciación de aminoácidos.
Las mejorías realizadas en la matriz de geles para IEF, empleando gradientes de pH inmovilizados (IPG), han logrado separaciones de punto isoeléctrico (pI) más estables y reproducibles para la primera dimensión. La separación de primera dimensión se realiza en geles ultradelgados con bajo porcentaje de acrilamida, que se colocan en un soporte de poliéster para facilitar su manipulación. Estos geles se convierten en geles de gradiente, cuyo pH se forma mediante buffers de acrilamida, tales como Immobilines® (GE Healthcare, Piscataway, NJ), logrando la unión mediante enlace covalente a la matriz de acrilamida. Los geles deben enviarse de modo seco y, previo a su uso, se deben hidratar con buffers, incluida la muestra en ciertas ocasiones. Cada tira se utiliza para separar una muestra proteica. Se aplica voltaje a las tiras de gel hidratadas, alcanzando así la separación durante una cantidad recomendada de voltios-horas (Vh). En el pasado, esto se determinaba multiplicando el voltaje por el número de horas durante las cuales se aplicaba. En la actualidad, la mayoría de los instrumentos incorporan un contador para registrar el voltaje a lo largo del tiempo y calcular así los Vh acumulados.
En un principio, las separaciones proteicas con tiras de IPG se realizaban sobre sistemas horizontales. Se utilizaban fuentes de alimentación externas para aplicar voltajes de hasta 5000 V, y se empleaban unidades de refrigeración externas para suministrar y controlar la temperatura de separación. En la década del ’90, se introdujeron instrumentos para combinar y consolidar la fuente de alimentación y la refrigeración en una única unidad integrada. Dicha unidad permitía voltajes más altos de hasta 10.000 V. Poco se ha modificado el diseño instrumental en los últimos diez años. Sin embargo, la unidad de isoelectroenfoque Hoefer IEF100 (Hoefer Inc., Holliston, MA) (Figura 1) recientemente desarrollada ofrece una serie de prestaciones y beneficios, incluido un mayor voltaje, para lograr mejor precisión de enfoque, mayor control de la potencia eléctrica que reduce la generación de calor, programación simplificada para facilitar su uso, monitoreo individual de las tiras para documentar la separación IEF, mayor control de la temperatura y una interfaz gráfica de usuario que brinda la rápida visualización del perfil de voltaje y corriente generado en la tira de la muestra. Los principales beneficios incluyen mejores resultados del desempeño de la muestra individual, la visualización del perfil de datos para cada tira, y tiempos de corrida más rápidos para las tiras de IPG que requieren gran cantidad de voltios-hora (Vh) totales para realizar el enfoque.
El instrumento utilizado para el isoelectroenfoque (IEF) de primera dimensión debe ser capaz de ofrecer alto voltaje para una alta resolución de proteínas. De acuerdo con las fórmulas de Rilbe de 1973, la resolución del isoelectroenfoque (IEF) depende de la raíz cuadrada del campo eléctrico. 1,2 Cuanto mayor sea la fuerza del campo aplicada, mayor será la resolución. La unidad Hoeffer IEF100 ofrece una salida de 12.000 V, el mayor voltaje que un producto del mercado puede ofrecer. Además, cada fabricante de tiras de IPG recomienda la cantidad de voltios-hora necesarios para lograr un buen enfoque utilizando sus tiras de IPG. El total de Vh necesarios varía según el rango de pH y la longitud de la tira de IPG. Es frecuente obtener valores de enfoque de voltios-hora (Vh) de 100.000 Vh, y los instrumentos IEF más recientes emplean voltajes muy altos para acelerar el tiempo de enfoque. Durante los últimos pasos de enfoque en la separación IEF, la aplicación de un mayor voltaje acumulará los Vh requeridos en un período más corto, algo que es muy simple de lograr con la unidad Hoefer IEF100.
El primer paso para generar resultados bidimensionales de gran calidad es efectuar una buena preparación de la muestra. En condiciones nativas, es posible que las proteínas posean solubilidad limitada. A fin de maximizar la solubilidad de una mezcla proteica, se utilizan agentes caotrópicos, tales como urea y tiourea, y detergentes no iónicos, como Triton X-100 (The Dow Chemical Co., Midland, MI), o detergentes zwitteriónicos, como CHAPS (3-[3-(colamidopropil)-dimetilamonio]-1-propanosulfonato) durante la hidratación de la tira de IPG y la preparación de la muestra. También se agregan agentes reductores para disminuir las uniones de disulfuro y desplegar las proteínas. La preparación de la muestra debe hacerse con cuidado a fin de reducir la cantidad de compuestos que aportan carga o conductividad a la matriz de la tira de IPG. Aquellas muestras con alta concentración de sales poseen mayor conductividad y es posible que esto impida que las tiras alcancen los voltajes máximos deseados. Esta mayor conductividad ralentiza los tiempos de enfoque y puede recalentar las tiras si no se controlan los límites del dispositivo IEF. En general, la corrida se inicia en baja potencia y a medida que avanza el tiempo se aumenta el voltaje. De este modo, las muestras migran lentamente a sus puntos isoeléctricos, minimizando el calor generado al inicio de la corrida, seguido de una fase de alto voltaje para conducir las proteínas a zonas de pI intensas. Instrumentos totalmente programables, tales como la unidad Hoefer IEF100, permiten la programación de múltiples pasos para aumentar gradualmente el voltaje aplicado a lo largo del tiempo y lograr así mayor flexibilidad. La capacidad de programación permite el intercambio de fases en la unidad, sin la intervención del usuario, y reduce además el riesgo de quemar las tiras.
La unidad Hoefer IEF100 permite controlar la potencia aplicada a la tira de IPG programando una corriente eléctrica constante en algunos o todos los pasos de un protocolo determinado. Esto ayuda a controlar la corriente y el voltaje aplicado a la muestra y evita el sobrecalentamiento. Por ejemplo, en un protocolo simplificado de dos pasos, primero se emplea baja potencia para iniciar la migración de sales y proteínas, y a medida que las proteínas y los iones se enfocan en distintas zonas, el movimiento iónico se desacelera y disminuye la conductividad de la tira. Cuando la corriente comienza a disminuir, se pueden aplicar voltajes más altos a las tiras. La posibilidad de controlar la potencia eléctrica también regula el calor generado durante la electroforesis.
La unidad Hoefer IEF100 tiene la capacidad de monitorear cada tira de IPG individual y mostrar la corriente individual de cada tira tanto de forma numérica como gráfica. La utilidad de esta característica puede observarse en los ejemplos de la pantalla gráfica y los geles 2-D resultantes para las tres tiras de IPG separadas en la unidad de enfoque Hoefer IEF100.
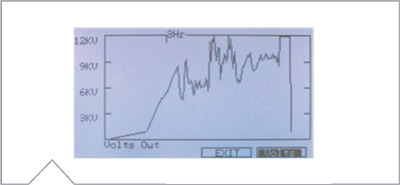
Figura 1 – Unidad de isoelectroenfoque Hoefer IEF100.
La Figura 2 muestra el voltaje total aplicado a todas las tiras bajo enfoque. Las Figuras 3a-c muestran la corriente generada en tres tiras de IPG.
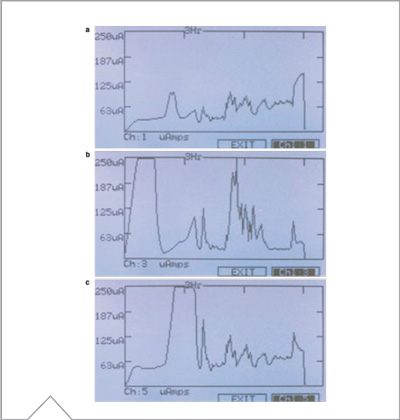
Figura 3 – a) Pantalla gráfica de la unidad Hoefer IEF100 que exhibe la corriente en μA generada del extracto de la muestra. b) Pantalla gráfica de la unidad Hoefer IEF100 que exhibe la corriente en μA generada del extracto de la muestra que contiene 25 mM de NaCl (cloruro de sodio). Se observa una elevada corriente al comienzo de la corrida, que luego crea picos a medida que la tira comienza a quemarse. c) Pantalla gráfica de la unidad Hoefer IEF100 que exhibe la corriente en μA generada del extracto de la muestra que contiene 50 mM de Tris. Se observa una corriente más alta más adelante en la corrida a medida que se incrementa el voltaje. En general, estas tiras poseen mayor conductividad que aquellas que no poseen Tris.
La Figura 3a muestra el perfil de corriente de una tira de IPG de 24 cm, gradiente de pH no lineal 3-10 con ~37 mg de extracto de Escherichia coli en urea 8 M estándar, 2% CHAPS, 0,05% buffer de Pharmalyte (GE Healthcare). La Figura 3b es una tira idéntica, pero con 25mM de sal (cloruro de sodio) añadida al buffer. La Figura 3c es una tira idéntica, pero con 50mM de Tris añadido al buffer. Resulta evidente, aun antes de completar el experimento, que la conductividad de cada tira es muy diferente. Las tiras sin aditivos generan una corriente bastante plana y pareja en toda la corrida, pero aquellas que contienen sal y Tris producen grandes picos de alta corriente a medida que avanza la corrida. Al observar los datos y compararlos con los gráficos de otras tiras o de corridas anteriores, es posible que el usuario conozca propiedades de la muestra que pueden conducir a resultados problemáticos.
Después de realizar el enfoque, se equilibraron las tiras en 50 mM de Tris-Cl pH 8,8, urea 6 M, 30% de glicerol, 2% de dodecilsulfato sódico (SDS) y 1% ditiotreitol, y se las colocó en gel de 12,5% de SDS. Se corrieron los geles SDS en el sistema de gel de segunda dimensión Hoefer SE900 (Hoefer Inc.) durante 30 minutos a 100 V, seguido de 6 horas a 80 mA por gel. Se realizó tinción con plata en los geles. Las imágenes de los geles (Figuras 4-6) muestran los problemas de interferencia de estos compuestos iónicos con los resultados finales en 2-D. Comúnmente, las imágenes 2-D aparecen con la región acídica a la izquierda y la región básica pI a la derecha. La segunda dimensión SDS separó las muestras en orden descendente (de mayor peso molecular a menor peso molecular). Al agregar sal (Figura 5) aparece una amplia región en blanco hacia el extremo básico (lado derecho) del gel 2-D, y manchas que resultan de la concentración de proteínas justo antes de dicho efecto de la sal. El agregado de Tris (Figura 6) generó puntos con enfoque deficiente y un mayor manchado horizontal. El usuario puede observar mediante la interfaz gráfica que las tiras presentaron variación en sus propiedades conductivas, y puede decidir si es necesario modificar las propiedades de la corrida para evitar el daño de la tira, si se debe retirar la tira de la corrida de enfoque o si la muestra debe someterse a una preparación diferente en el futuro.

Figura 4 – Tinción de plata de un resultado de gel 2-D generado mediante el uso de una tira de IPG de 24 cm, pH 3-10 NL, con ~37 mg de extracto de E. coli en urea 8 M estándar, 2% CHAPS, y 0,05% de buffer Pharmalyte.

Figura 5 – Tinción de plata de un resultado de gel 2-D generado mediante el uso de una tira de IPG de 24 cm, pH 3-10NL, con ~37 mg de extracto de E. coli en urea 8 M estándar, 2% CHAPS, 0,05% de buffer Pharmalyte con 25 mM de NaCl. Se observa una región en blanco en el extremo derecho (básico) de la tira de IPG, donde el sodio interfiere con el patrón 2-D. Es evidente el área en que la tira se quema al observar la marca amarilla que desciende por el gel en forma vertical.

Figura 6 – Tinción de plata de un resultado de gel 2-D generado mediante el uso de una tira de IPG de 24 cm, pH 3-10NL, con ~37 mg de extracto de E. coli en urea 8 M estándar, 2% CHAPS, 0,05% de buffer Pharmalyte con 50 mM de Tris. Se observa un deficiente enfoque de la muestra, en especial del lado acídico (izquierda) del gel 2-D.

Figura 7 – Resultado de aplicar un voltaje demasiado elevado a una tira de 24 cm que contiene 25 mM de sodio. La tira de IPG ha comenzado a quemarse como se puede observar por la decoloración y el daño al gel de IPG. La interfaz gráfica de la unidad Hoefer IEF100 muestra corrientes erráticas a medida que la conductividad en el área dañada cambia hasta formar un arco (Figura 3b).
La captura de la información sobre la corriente de la tira de IPG en tiempo real les permite a los usuarios un mayor control de la separación y una mejor toma de decisiones en relación con las muestras problemáticas o de alta conductividad. Estas muestras altamente conductivas pueden limitar el voltaje o corriente máximos disponibles para toda la corrida. Tal como lo describe Görg,3 un bajo voltaje durante períodos prolongados al inicio de la corrida puede contribuir a la desalinización de la muestra antes de la separación IEF. Cuando el usuario observa que una tira posee conductividad muy alta al inicio de la corrida, puede modificar el protocolo a fin de incluir una fase de desalinización de bajo voltaje o retirar la tira del experimento, ya que una mayor conductividad puede limitar los parámetros de corrida. Sin la correcta desalinización, es posible que las tiras se sequen y se quemen (véase Figura 7). La unidad Hoefer IEF100 es capaz de mostrar la conducta errática de una tira de IPG que se quema (tal como se observa en las Figuras 2 y 3b). La capacidad de monitorear cada tira de IPG de forma individual brinda información inmediata al investigador. Esta valiosa información puede utilizarse para sugerirle al investigador que modifique la preparación de la muestra o los parámetros de corrida y así evitar una falla en la corrida.
En algunos casos se añaden otros compuestos iónicos, tales como Tris, en los buffers de extracción de muestra, o se los agrega para ajustar el pH de la preparación de la muestra. Smejkal4 destaca que estos iones son capaces de crear límites que no pueden ser atravesados por las proteínas, lo que restringe la posibilidad de alcanzar un enfoque verdadero. En los ejemplos con Tris (Figura 3c), el perfil de corriente es mayor y más plano que el de la muestra que no contiene Tris. Además, el patrón del gel muestra una interrupción. Para evitar las complicaciones de los aditivos, puede ser de utilidad realizar una limpieza de la muestra antes del IEF, a fin de eliminar los compuestos iónicos.
Además de mostrar el perfil de voltaje y corriente (datos) en la pantalla de cristal líquido (LCD) de la unidad Hoefer IEF100, es posible enviar todos los parámetros de la corrida a una impresora externa o almacenarlos en una computadora (Figura 8). La posibilidad de importar los datos a una planilla de cálculos como Microsoft® Excel™ les permite a los usuarios generar un gráfico de todos los parámetros de la corrida. De ese modo, pueden llevar un registro permanente de los parámetros de configuración, correr las condiciones y diagnosticar los problemas que puedan surgir durante el enfoque.
El control de la temperatura también resulta muy importante para alcanzar resultados reproducibles y evitar la ocurrencia de “hot spots” (manchas). El punto isoeléctrico (pI) de una proteína depende de la temperatura de la separación. Una separación a 20 °C podría ser muy diferente a una que se realiza a 25 °C. Bajo condiciones desnaturalizadas, las temperaturas superiores a 37 °C pueden resultar perjudiciales para la separación proteica. Calentar las muestras en soluciones de urea puede carbamilar las proteínas e introducir cambios en las cargas, lo que es indeseable cuando la separación proteica se basa en la carga. Se pueden producir “hot spots” en zonas de alta conductividad, como áreas que contienen alta concentración iónica. Es importante disipar el calor rápidamente a fin de prevenir el calentamiento excesivo en regiones localizadas. La unidad Hoefer IEF100 está equipada con una placa de enfoque con enfriamiento Peltier que controla con precisión y exactitud la temperatura de separación.
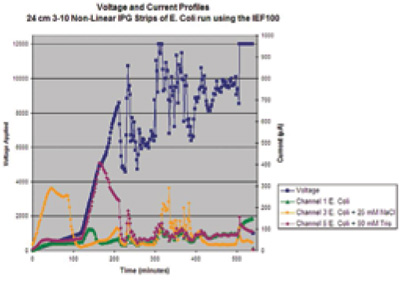
Figura 8 – Gráfico de los parámetros registrados durante una corrida de IEF utilizando la unidad Hoefer IEF100. El eje y a la izquierda representa el voltaje sobre el tiempo (eje x). El segundo eje y representa la corriente de las tiras IPG individuales sobre el tiempo. Es importante mencionar que el canal que contiene sal (Figura 3b, canal 3) posee una conductividad muy elevada (lo demuestra el alto nivel de μA) al inicio de la corrida, y desciende eventualmente a medida que las sales y las proteínas migran en la tira de IPG. A pesar de que este gráfico muestra los parámetros para tres de los seis canales, la unidad Hoefer IEF100 registra los parámetros para cada uno de los seis canales de enfoque además de los voltios por hora, W, y temperatura de la corrida.
Conclusión
El control de la temperatura, la aplicación de alto voltaje y la recolección de datos en cada muestra individual convierten a la unidad Hoefer IEF100 en una valiosa herramienta para la investigación proteómica.
—————————————————————
Acerca de la unidad de isoelectroenfoque de primera dimensión:
El equipo puede controlar el flujo de corriente de cada tira de IPG en tiempo real a través de 9 protocolos editables precargados integrados pudiendo almacenar hasta 30 protocolos permitiendo una programación flexible para resultados precisos.
La unidad puede correr con hasta siete tiras de IPG de 7 a 24 cm al mismo tiempo y es el único instrumento de primera dimensión que controla la corriente y el voltaje que se aplican a las tiras de IPG para prevenir el sobrecalentamiento. Su suministro de energía integrado y sistema de enfriamiento Peltier, minimiza el impacto ecológico.
Los alcances en los tiempos de corrida son más rápidos debido a su alimentación integrada de 12.000 voltios que proporciona el mayor voltaje y corriente disponibles en el mercado.
Es posible visualizar todo el protocolo en la pantalla, lo que facilita su lectura y edición proporcionando resultados gráficos de tiempo real.