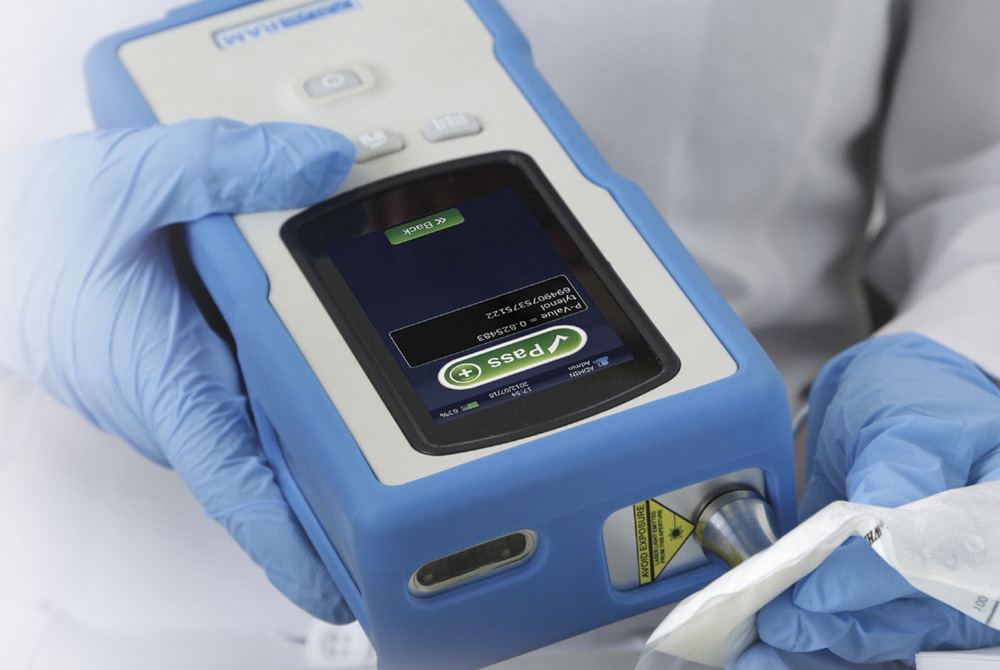
Los beneficios de contar con un espectrómetro Raman portátil y de alto rendimiento para la rápida identificación de materias primas en la industria farmacéutica

Dawn Yang y Robert Thomas
B&WTek Scientific Solutions
En los últimos años, la espectroscopía Raman ha ganado reputación en los segmentos de mercado que requieren la identificación rápida de compuestos desconocidos, como el análisis de productos químicos de alta pureza, la medición de ingredientes farmacéuticos y la caracterización de polímeros. Las razones detrás de este interés se deben a que la instrumentación Raman emplea software inteligente para la toma de decisiones y bibliotecas espectrales integradas, lo que la convierte en una técnica ideal para propósitos de análisis molecular.
A diferencia de las técnicas analíticas tradicionales como HPLC, FTIR y espectroscopía NIR, que requieren exhaustivos procedimientos para la preparación de muestras, el equipamiento Raman puede emplearse en un entorno de producción o en aplicaciones de campo, dado que no requiere prácticamente pre-tratamiento de la muestra, ni ningún contacto directo con la misma, y cuenta con la capacidad única de poder realizar el análisis de la muestra a través de un material contenedor transparente, como vidrio o plástico.
En la actualidad, la instrumentación Raman es más veloz, robusta y menos costosa, y junto con los avances en el campo de la miniaturización de componentes han conducido al diseño de dispositivos Raman manuales, portátiles y de alto rendimiento. En particular, la reducción del tamaño ha acercado la tecnología a nuevas áreas de aplicación que no eran posibles con la tecnología más grande, engorrosa y obsoleta del pasado.
Los instrumentos Raman portátiles se adaptan perfectamente para su aplicación en la industria farmacéutica, como el análisis de las materias primas, la verificación de productos finales [1] y la identificación de fármacos falsificados, debido a la selectividad molecular extremadamente elevada de la técnica [2].
Principios de la espectroscopía Raman
Al igual que las técnicas de absorción infrarroja (IR), la espectroscopía Raman mide los modos vibracionales, rotacionales y otros de baja frecuencia de una molécula. Mientras que la espectroscopía IR dirige una amplia gama de longitudes de onda IR de luz sobre una muestra y mide aquellas que se absorben, el espectro Raman dirige una única longitud de onda de luz y recoge la luz “dispersa” resultante. Las frecuencias de la luz dispersa dependen de la fuerza de la unión de las moléculas, la masa de los átomos unidos y otros factores como las interacciones intermoleculares. El patrón de las frecuencias vibracionales y rotacionales de una molécula es altamente característico de una determinada especie molecular o de la fórmula estructural de las moléculas [3].
Un analizador Raman típico de laboratorio consta de cinco componentes principales: una fuente de luz monocromática fuerte que excita la muestra (p. ej.: un láser), el dispositivo colector o de enfoque, el espectrógrafo, el detector y el software de pos-procesamiento. La técnica opera sobre las moléculas de la muestra que dispersan la luz del láser de modo inelástico, y luego un espectrómetro Raman recoge y analiza la luz dispersa para producir un espectro. Por lo general, los espectros Raman poseen buenas características que permiten la determinación e identificación inequívoca de los compuestos moleculares. De todos modos, es importante mencionar que muchos materiales experimentan auto-fluorescencia al ser excitados por una fuente láser, lo que interfiere con la señal Raman y reduce la capacidad de obtener una señal Raman sin interferencias de un determinado material. Por lo tanto, a menos que los algoritmos post-procesamiento de los espectrómetros estén diseñados para compensar estas interferencias potencialmente significativas, los datos generados podrían resultar confusos y difíciles de interpretar.
Análisis de productos farmacéuticos
Tradicionalmente, el control de calidad de las materias primas ha implicado el uso de equipamiento de monitoreo en línea o algún equipo espectroscópico infrarrojo portátil, a fin de realizar el análisis de lotes seleccionados de ingredientes químicos. Además, la verificación del producto farmacéutico final requiere de métodos mucho más estrictos, por lo que ha sido realizada tradicionalmente por químicos analíticos altamente especializados, que debieron llevar a cabo procedimientos de extracción y análisis de los compuestos utilizando técnicas complejas que insumen mucho tiempo, como la química húmeda, la cromatografía líquida o la espectroscopía de masas.
Si bien este abordaje ha funcionado razonablemente bien, resulta muy lento, no ha demostrado ser efectivo en cuanto al costo, y genera enormes cuellos de botella en el muestreo, en especial debido a que la FDA establece que todas las empresas farmacéuticas deben analizar cada materia prima que llega a la planta de producción. Es por esto que las empresas que desarrollan equipos analíticos han trabajado con la industria farmacéutica para crear soluciones innovadoras que reemplacen los actuales procesos de análisis con el objetivo de aumentar la realización de análisis al tiempo que se reducen los costos totales.
La tecnología que ha demostrado ser la más apta para este tipo de procesos es la espectroscopía Raman, que posee la capacidad de determinar rápidamente la autenticidad del contenido de un recipiente con materia prima o de un producto farmacéutico final de acuerdo con las comparaciones espectrales con las bibliotecas integradas. Gracias al reciente desarrollo de pequeños dispositivos portátiles, esta técnica puede emplearse en cualquier lugar de la planta de producción para brindarle al operador una respuesta inmediata sobre la validez química del material.
Desafíos actuales
El rendimiento del equipo Raman portátil ha mejorado tanto en los últimos años que ahora se lo utiliza para analizar compuestos más complejos en procesos como diferenciación entre los distintos materiales aglutinantes y materiales para la elaboración de comprimidos empleados en la industria farmacéutica, como celulosa, celulosa micro-cristalina, hidroxipropil metilcelulosa (HPMC) y los materiales de hidrógeno fosfato de calcio, y para caracterizar los aditivos de los alimentos, como la maltodextrina y la lactosa. En el pasado, la identificación de este tipo de compuestos solo podía lograrse utilizando sistemas de laboratorio aptos para investigación, que proveían un alto poder de determinación y mejor relación señal-ruido. El problema inherente es que debido a la naturaleza de gran fluorescencia de compuestos como el HPMC, los materiales de celulosa y los aditivos de alimentos basados en sacáridos, las características de los equipos Raman no logran suficiente selectividad. El desafío que debe enfrentar hoy la industria con el uso de sistemas tradicionales Raman portátiles es la selectividad relativamente deficiente y el prolongado tiempo de análisis, que generan problemas de confiabilidad e inconsistencias en los métodos de análisis.
Sin embargo, los recientes avances en el área de diseño óptico, detectores, tecnología de enfriamiento termo-eléctrico y algoritmos de software inteligente muestran que ahora es posible combinar la espectroscopía Raman de alto rendimiento con la simplicidad y conveniencia de un diseño compacto. A modo de ejemplo, realizamos una investigación acerca de la eficiencia de un espectrómetro Raman portátil recientemente comercializado, diseñado para la rápida identificación de materias primas, a fin de determinar si podía diferenciar entre un grupo de materiales de celulosa y aditivos alimentarios.
Todos los datos presentados en este estudio fueron realizados con un espectrómetro Raman portátil NanoRam@ estándar (B&W Tek, Newark, DE) [4]. El NanoRam está descripto en la literatura general, pero básicamente consiste en un compacto espectrómetro portátil Raman con un sistema informático integrado S-24 para la identificación y verificación de materiales en instalaciones que cumplen con las buenas prácticas de manufactura vigentes (GMP) [5]. Con un peso menor a 1 kg, permite el rápido desarrollo de métodos estandarizados y validados para facilitar la inspección con fines de pureza y calidad. Es posible obtener la confirmación de un compuesto desconocido en menos de 20 segundos, lo que lo convierte en una opción práctica para la identificación y verificación de productos farmacéuticos [6].
El corazón del dispositivo consta de una fuente de excitación láser de longitud de onda de 785 nm con un espectrómetro tipo Czerny-Turner y un detector CCD enfriado termoeléctricamente (TE), que proporciona una señal muy estable con bajo ruido de fondo. La figura 1 muestra los beneficios de un detector con control de temperatura para reducir el ruido de fondo e ilustra el recuento oscuro (ruido) para un espectrómetro CCD sin refrigeración a temperatura ambiente y para un espectrómetro con enfriado termoeléctrico, operado a 18°C, utilizando un tiempo de integración de 30 segundos. La media cuadrática (RMS) calculada del nivel de ruido del espectrómetro enfriado termoeléctricamente (a la derecha) es aproximadamente cinco veces menor que la unidad no refrigerada [7].
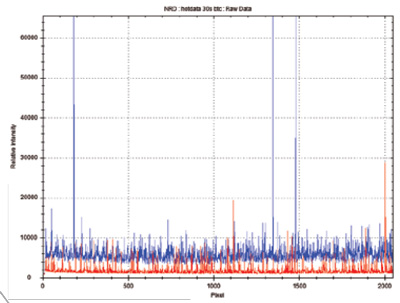
Figura 1 – Ruido de corriente oscura para un espectrómetro CCD no refrigerado a temperatura ambiente (izquierda) y un espectrómetro CCD enfriado termoeléctricamente a 18° C (derecha).
La combinación del enfriado termoeléctrico con la tecnología patentada de estabilización láser y un microprocesador de alta velocidad ofrece un rendimiento apto para laboratorio en un cómodo equipo portátil.
Posee la capacidad de generar una elevada especificación en la relación de señal a ruido de fondo, lo que resulta necesario para el correcto análisis y la confirmación de diferentes compuestos farmacéuticos de celulosa y aditivos alimenticios.
Caracterización de diferentes materiales y aditivos utilizados en la industria farmacéutica y alimenticia
Para la presente investigación se emplearon los siguientes materiales como agentes aglutinantes, rellenos, aditivos y suplementos (todos consistían en polvo blanco con aspecto similar):
- Dos clases de materiales de celulosa (aglutinantes/rellenos)
- Celulosa
- Celulosa microcristalina (Avicel)
- Cinco clases de hidroxipropil metilcelulosa (HPMC)
- Compuestos (aglutinantes/rellenos)
- Methocel #1
- Methocel # 2
- Methocel # 3
- Metolosa
- Hipromelosa
- Lactosa (agente endulzante/relleno)
- Maltodextrina (agente endulzante/aditivo alimenticio)
- Dihidrato de fosfato de calcio (CaHP04·H,o) (aglutinante/suplemento dietario)
Procedimiento de análisis
Los parámetros operativos estándar empleados en este estudio se ilustran en la Tabla 1.
El procedimiento de análisis implica la calibración del dispositivo mediante el uso de formas puras de cada uno de los compuestos a fin de desarrollar y almacenar métodos para analizar y caracterizar todos los demás materiales. Cada “método” del instrumento recoge al menos 20 tomas del tipo de material específico, que le permite al usuario incluir leves variaciones en la posición del muestreo, los materiales y lotes de empaque, además de las inconsistencias asociadas a los distintos operadores que llevan a cabo el análisis. El método realizado a medida para cada material incluye un algoritmo de software propietario en el que se compara el espectro Raman y se lo combina con el espectro del método para generar un valor p numérico a partir del cual se determina el resultado de aprobado/desaprobado (PASS/FAIL). Los métodos creados de este modo no solo se relacionan a las características únicas de los materiales, sino que garantizan un método resistente y robusto para lograr un procedimiento de análisis confiable y necesario para la identificación inequívoca del material. Una vez desarrollado el método, el tiempo total de escaneo y el proceso de toma de decisión duran aproximadamente 20 segundos hasta obtener la “aprobación/desaprobación” del material.
La Figura 2 muestra un análisis Raman de material de celulosa (trazo azul) utilizando el “Método de Celulosa” almacenado que se generó a partir de un estándar de referencia que fue el resultado de un promedio de 20 análisis Raman de material de celulosa (trazo rojo). Como puede observarse, se obtiene un valor p de 0,9982, que se considera perfectamente apto comparado con el material de referencia (un valor p de 1,000 se considera perfecto). Cabe mencionar que los espectros Raman del material de referencia de celulosa pura fueron compensados en 1000 unidades de intensidad, en comparación con la muestra desconocida, con fines de aclaración. Por lo tanto, esta muestra desconocida se evaluaría como “aprobada” para celulosa.
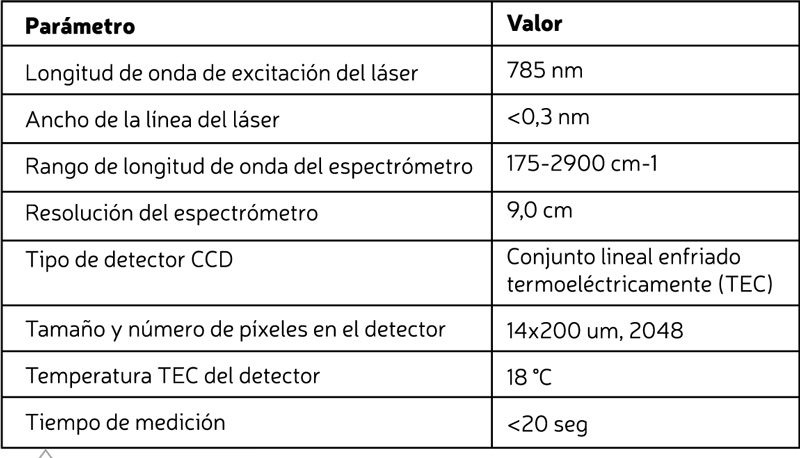
Tabla 1. Parámetros operativos del equipo Raman portátil para la caracterización de productos farmacéuticos
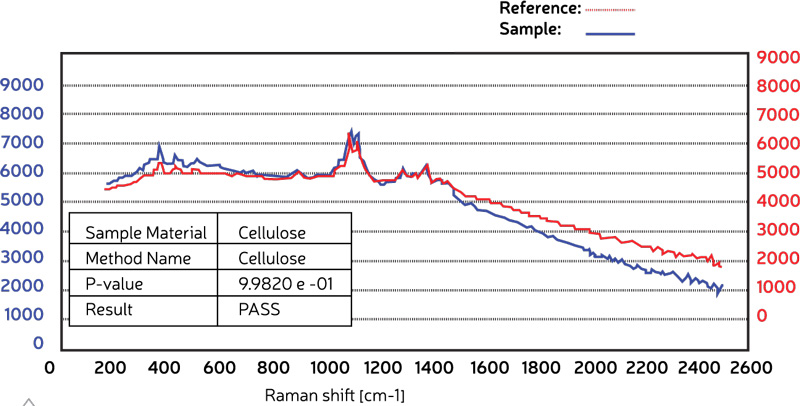
Figura 2 – Espectro Raman de una muestra de celulosa (azul) en comparación con el método de celulosa almacenado (rojo). El valor p de la tabla muestra que la celulosa se confirmó como tal.
Al comparar, la Figura 3 muestra un análisis de celulosa en equipo Raman empleando un método estándar generado para HPMC. Se puede observar con claridad que el espectro Raman para la muestra (azul) es muy diferente al análisis de referencia de HPMC (rojo), según lo indica el valor p para la muestra, que es de 2,23716 –e 06. Por lo tanto, esta muestra desconocida, se evaluaría como “desaprobada” para HPMC.
Si se desaprueba un material de muestra, el algoritmo de software realiza una evaluación “probable” de la identificación del material en base a la biblioteca de métodos e información espectral almacenada. Esto se ejemplifica en la Tabla 2, en donde se observan todos los materiales analizados con el “Método de celulosa”. Tanto la celulosa como la celulosa microcristalina aprobaron el análisis de identificación de celulosa, mientras que el resto de los materiales lo desaprobó. Sin embargo, los materiales desaprobados en el análisis de celulosa se evalúan posteriormente con las bibliotecas espectrales integradas y se logró confirmar el material correcto con una precisión cercana al 100% de acuerdo con el Índice de Calidad de Acierto (HQI) en la columna final. La evaluación de los espectros Raman emplea la nomenclatura HQI, que se define como la similitud de dos espectros al comparar un espectro desconocido y un espectro de biblioteca mediante una prueba de correlación. Un valor HQI de 1,00 (100%) indica que el espectro desconocido es idéntico al espectro de la biblioteca, y se reduce el valor a medida que el espectro desconocido y el de la biblioteca se vuelven más disímiles entre sí [8]. De hecho, en el caso de todos los materiales que desaprobaron el análisis de un método específico, el valor HQI promedio fue superior al 97%, lo que indica que la comparación del espectro desconocido con el espectro de referencia conocido en la biblioteca fue extremadamente precisa.
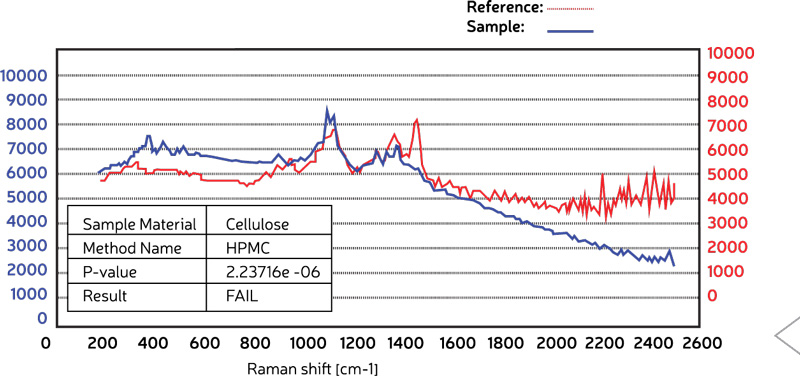
Figura 3 – Espectro Raman de un material de celulosa (azul) en comparación con el método HPMC almacenado (rojo). El valor p de la tabla muestra que la celulosa NO se verificó como HPMC.
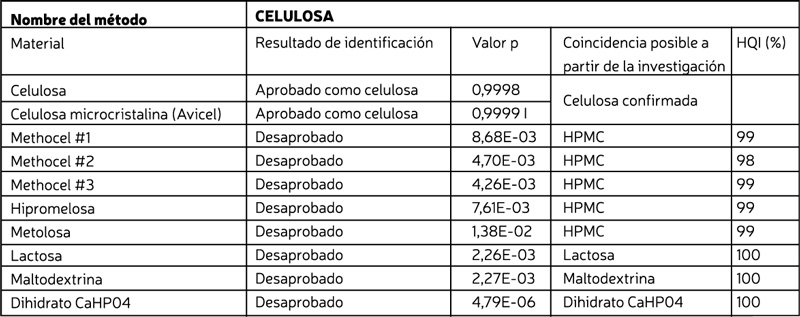
Tabla 2. Resultados de todos los materiales analizados y evaluados a través del “Método de celulosa”
La investigación ha hecho hincapié claramente en que las materias primas y los aditivos empleados en la industria farmacéutica y alimenticia pueden analizarse e identificarse con éxito a través de la tecnología portátil Raman, alcanzando un alto grado de confianza en menos de 20 segundos. También ha demostrado que incluso cuando un compuesto no supera la prueba, los algoritmos del software y las bibliotecas espectrales integradas pueden brindar una evaluación muy precisa de la identificación probable de dicho compuesto. Estas capacidades convierten a esta técnica en ideal para la identificación y verificación inequívoca de las materias primas que ingresan al entorno de producción de alimentos y productos farmacéuticos.
La última parte de la investigación consistió en analizar todos los polvos utilizando métodos específicos generados por cada uno de los materiales puros de referencia. Los resultados de esta prueba se describen en la Tabla 3. Los casilleros de color muestran que el sistema portátil Raman ha confirmado correctamente todos los materiales analizados a través de sus métodos respectivos como lo indican los casilleros en color verde (Aprobado), mientras que los otros materiales no superaron la prueba de acuerdo con los casilleros color rojo y marrón (Desaprobado). Es importante destacar que las referencias de color que se encuentran debajo de la tabla muestran los rangos reales del valor p, que indican la severidad de la falla; en otras palabras, cuanto menor sea el valor, peor será la falla.
Conclusión
La investigación ha hecho hincapié claramente en que las materias primas y los aditivos empleados en la industria farmacéutica y alimenticia pueden analizarse e identificarse con éxito a través de la tecnología portátil Raman, alcanzando un alto grado de confianza en menos de 20 segundos. También ha demostrado que incluso cuando un compuesto no supera la prueba, los algoritmos del software y las bibliotecas espectrales integradas pueden brindar una evaluación muy precisa de la identificación probable de dicho compuesto. Estas capacidades convierten a esta técnica en ideal para la identificación y verificación inequívoca de las materias primas que ingresan al entorno de producción de alimentos y productos farmacéuticos.
Referencias
- An Implementation Perspective on Handheld Raman Spectrometers for the Verification ofMaterial Identity: B. Diehl, C.S. Chen, B. Grout, J. Hernandez, S. O’Neill, C. McSweeney, J. M. Alvarado and M. Smith, Pfizer Inc; European Pharmaceutical Review, Non-destructive Materials Identification Supplement, Volume 17, Issue 5,2012, http://www. europeanpharmaceuticalreview.com/wp-content/uploads/RamanSupplement-2012.pdf
- Portable Raman Spectroscopy for Pharmaceutical Counterfeit Detection: R. Kalyanaraman, M. Ribick and G. Dobler, Bristol-Myers Squibb; European Pharmaceutical Review, Non-destructive Materials Identification Supplement, Volume 17, Issue 5, 2012; http://www. europeanpharmaceuticalreview.com/wp-content/uploads/RamanSupplement-20 12.pdf
- Fundamentals ofRaman Spectroscopy: T. Thompson, Laser Focus World, Editorial Digest, September, 2011;http://bwtek.com/wp-content/ uploads/downloads/2012/06/Appnote_Fundamentals_oCRaman_ Spectroscopy.pdf .
- The NanoRam Hand-held Raman Spectrometer: Ideally-suited for the Inspection ofRaw Materials and Chemicals Used in the Pharmaceutical industry: B&W Tek Application Note; http://bwtek.com/wp-content/ uploads/downloads/20 12/06/ Appnote_NanoRam_lnspection.pdf
- The NanoRam Hand-held Raman Spectrometer: Full Regulatory Compliance for the Inspection ofRaw Materials and Chemicals Used in the Pharmaceutical Industry: B&W Tek Application Note; http://bwtek. com/wp-content/uploads/downloads/2012/06/Appnote_NanoRam_Compliance.pdf
- Small But Perfectly Formed: World Pharmaceutical Frontiers; http:// www.worldpharmaceuticals.netlmarketresources/021 /WPF021_ bandwtek.html
- Advantages ofTE cooled miniature fiber optic spectrometers for Raman and Fluorescence spectroscopy: B&WTek Application Note; http://www. photonicsonline.com/articJe.mvcITE-Cooled-Miniature-Fiber-OpticSpectrometers-0002
- Spectral Preprocessing for Raman Library Searching: J. Kaufmann, J.D. Rodrigues, L.F. Buhse, American Pharmaceutical Review, Volume 14, Issue 4, May/June 2011; http://www.americanpharmaceuticalreview.com/Featured-ArticJes/36904-Spectral-Preprocessing-for-RamanLibrary-Searching/














