Aplicaciones de calorimetría de titulación isotérmica y calorimetría de barrido diferencial en el desarrollo de la formulación biofarmacéutica

M. Woods, M. Puri, D. Doucet, T. Derrick, S. Morar-Mitrica y D. Nesta
Biopharmaceutical Technologies, GlaxoSmithKline R&D, 709 Swedeland Rd,King of Prussia, PA 19406 (USA)
Introducción
El desarrollo de las terapias basadas en proteínas constituye una tarea desafiante debido a la inestabilidad inherente de las proteínas, que puede manifestarse como inestabilidad física (despliegue, agregación, adsorción) y degradación química (oxidación, desamidación y escisión).Dichas inestabilidades pueden generar una menor actividad de la proteína o incluso provocar la generación de especies potencialmente inmunogénicas. Un abordaje para alcanzar la estabilización de las proteínas implica modificar las propiedades del solvente que está en contacto con las mismas. Esto puede lograrse mediante la cuidadosa selección del sistema de buffer, el ajuste del pH y el agregado de excipientes/aditivos (es decir, creando una formulación óptima).
Un factor importante para lograr la estabilización de las drogas proteicas mediante el uso de solventes reside en la elección de los excipientes adecuados. Es fundamental optimizarlas concentraciones de los excipientes, que ofrecen una vida útil más prolongada y garantizan la mayor seguridad para el paciente. De este modo, un aspecto esencial del desarrollo de la formulación de drogas proteicas reside en la selección de aquellos excipientes que sean adecuadamente solubles y no tóxicos, mantengan la integridad estructural de la proteína, permitan una vida útil aceptable del producto y conserven la actividad biológica del mismo. Estos excipientes pueden incluir aminoácidos, sales, metales, surfactantes, azúcares, polioles, y polímeros. Pueden actuar como estabilizadores, agentes activos de superficie, agentes antimicrobianos, o antioxidantes. Por lo general, su efecto estabilizador es específico de las proteínas y depende de la concentración.
Además de la selección de los excipientes, es necesario recabar información no solo de la concentración óptima de los mismos, sino también de las interacciones entre los diversos componentes de la formulación. Optimizar la selección y la concentración de cada excipiente puede resultar una tarea de gran esfuerzo, que exige la realización de extensos estudios de estabilidad y detección de la formulación. Si bien en la última década la bibliografía nos ha presentado los principios generales de la estabilización (1), aún no se logran comprender por completo los mecanismos mediante los cuales los excipientes pueden mejorar la estabilidad de una proteína durante su almacenamiento. Un mayor conocimiento del mecanismo de interacción de los excipientes con las proteínas podría eliminar un abordaje de detección puramente empírico y permitir el diseño y la optimización racional de la formulación de proteínas, reduciendo así los requerimientos de tiempo y materiales para el desarrollo de productos proteicos. Más aún, la información acerca de la fuerza y el tipo de interacción proteína-excipiente podría contribuir a predecir el comportamiento de la droga proteica in-vivo.
Las técnicas de análisis biofísico han demostrado ser de gran utilidad en la detección de excipientes para el desarrollo de formulaciones. En especial, la calorimetría representa uno de los métodos más eficaces para evaluar la estabilidad y las interacciones proteicas, ya que permite la caracterización termodinámica completa del sistema, siempre y cuando todos los eventos sean reversibles. Las investigaciones calorimétricas que exploran las interacciones entre proteínas y excipientes se han aplicado cada vez más al diseño y la optimización de las formulaciones biofarmacéuticas. El principio de la calorimetría es la determinación de la energía y de la estequiometría de las interacciones macromoleculares, midiendo los cambios térmicos que resultan de los procesos de asociación, disociación y/o despliegue. La calorimetría de titulación isotérmica (ITC en inglés) se utiliza principalmente para determinar los parámetros termodinámicos de unión, tales como la afinidad de enlaces y las constantes de disociación, así como también la estequiometría, la entalpía, la entropía y la energía libre de Gibbs de enlace bajo condiciones isotérmicas. También puede emplearse para determinar los cambios en la capacidad calórica al momento del enlace, realizando experimentos a lo largo de un rango de temperaturas. Los datos de la calorimetría de barrido diferencial (DSC en inglés) brindan los parámetros termodinámicos del despliegue de proteínas, incluida la temperatura en el punto medio de despliegue, la entalpía, la entropía, la energía libre de Gibbs y los cambios en la capacidad calórica al momento del despliegue.
Por lo general, estos parámetros termodinámicos se utilizan para comparar la estabilidad de las proteínas en las diferentes formulaciones, o para determinar los efectos de estabilización o desestabilización relativa de determinados excipientes.
La presente nota de aplicación es un ejemplo de la forma en que la calorimetría contribuyó al desarrollo de la formulación de ProX, brindando información detallada acerca de las interacciones excipiente-proteína. Se evalúa el uso del polisorbato-80 y el fenol como potenciales aditivos al buffer de formulación para ProX. El polisorbato-80 es un surfactante comúnmente utilizado para prevenir la adsorción no específica y la agregación de proteínas; su interacción con las proteínas (2, 3) ya ha sido demostrada. Protege la proteína frente a la agregación inducida por la superficie, al unirse a las regiones hidrofóbicas expuestas en la superficie de la molécula proteica (3).Los niveles más comúnmente utilizados de polisorbato-80 varían de 0,002 a 0,1% (p/v). El fenol se emplea como agente antimicrobiano para aquellas formulaciones del mismo recipienteque se dosificarán más de una vez. El fenol es tóxico, por lo tanto, deberá minimizarse la concentración utilizada en el buffer de formulación. Los niveles más comúnmente empleados oscilan entre 0,3 y 0,5 % (v/v).
Materiales y métodos
Calorimetría de barrido diferencial (DSC)
Se utilizó un sistema MicroCalTM VP-Capillary DSC para realizar los experimentos. Se colocaron cuatrocientos (400) µl de cada muestra y su correspondiente buffer en una placa de 96 pocillos.Se barrieron las muestras con un incremento de 25ºC a 100ºC a una tasa de barrido de 60ºC por hora, con un equilibrio de 15 minutos previo a cada barrido. Se empleó el software Origin versión 7 para analizar los datos de la calorimetría DSC, después de la sustracción del búfer y la corrección de la concentración del barrido de proteínas.
Calorimetría de titulación isotérmica (ITC)
Se utilizó un sistema MicroCal iTC200 para realizar los experimentos. Se colocaron 250 µl de 10 o 25 mg/ml de ProX en la celda de muestra, y se llenó la jeringa tituladora con 40 µl de 60 mM de fenol o 50 mM de polisorbato-80 en el mismo buffer que ProX. La celda de referencia se llenó con agua desionizada. Para cada experimento se inyectaron 40 µl de solución tituladora en la celda de muestra en alícuotas de 0,2 a 2 µl a una tasa de 0,5 µl por segundo. Se emplearon los siguientes parámetros: velocidad de agitación, 1000 rpm, potencia de referencia, 5 a 8 µCal por segundo, modo de feedback/ganancia ajustado en alto, temperatura 25ºC, demora inicial, 60 segundos. En cada experimento se obtuvieron las corridas de control de buffer en buffer, la dilución tituladora y la dilución ProX. Se empleó el software Origin versión 7 para el análisis de datos de ITC. Antes de utilizar las muestras para las corridas de ITC, se las filtró con filtros de jeringa de baja unión a proteínas de 0,2 µm (Pall Life Sciences), y se dializó cada muestra de proteína en el mismo buffer utilizado para preparar la solución de excipientes, a fin de garantizar el mismo buffer en la jeringa y en la celda.
Resultados
El enlace directo de los excipientes con el ingrediente activo de un producto farmacéutico puede afectar el producto de diversas formas. Recientes estudios demostraron que los excipientes comúnmente utilizados en las formulaciones farmacéuticas pueden afectar la farmacocinética de las drogas activas (4, 5). Los excipientes también podrían alterar la estructura o la biodisponibilidad de la droga proteica, lo que resultaría en cambios en la potencia. Además de un cambio potencial en la farmacocinética o en la potencia del ingrediente activo, las interacciones entre excipientes y proteínas pueden afectar la vida útil o la seguridad de la droga. Por lo tanto, se debe reconocer y comprender la interacción de la proteína con los excipientes de la formulación. Si se detecta una interacción directa (es decir, el enlace mensurable) entre la proteína y los excipientes de la solución, se deberán tener en cuenta dos características importantes al diseñar la formulación de una droga proteica. En primer lugar, la fuerza y/o reversibilidad del enlace del excipiente a la proteína, que podría obstaculizar o enmascarar por completo un sitio crítico activo en la superficie de la proteína tras la administración clínica y, en segundo lugar, la concentración del excipiente no enlazado, que debe ser suficiente como para alcanzar las propiedades deseadas de la solución. Cada uno de estos aspectos se ejemplifica a continuación para ProX.
Interacción de ProX con polisorbato-80
La Figura 1 muestra los resultados de un experimento de calorimetría de titulación isotérmica (ITC) en el que se inyectaron 50 mM de polisorbato-80 en 25 mg/ml de ProX. Los datos crudos se ilustran en el panel (A), y el calor integrado por inyección posterior a la sustracción de las corridas de control se encuentra en el panel (B).Los datos del panel (B) muestran que realmente existe una interacción mensurable entre el polisorbato-80 y ProX. Los datos incluyeron un modelo de único sitiocon la constante de afinidad de enlace (KA) = 1430 ± 260 M-1, entalpía de enlace (ΔH) = -6,3 ± 1,1 kcal/mol, y número de sitios de enlace (n) por molécula de ProX igual a 2,6 ± 0,3. El cambio de enlace de la entropía (ΔS) se calculó según el supuesto -6,7 ± 3,7 cal/mol-K.
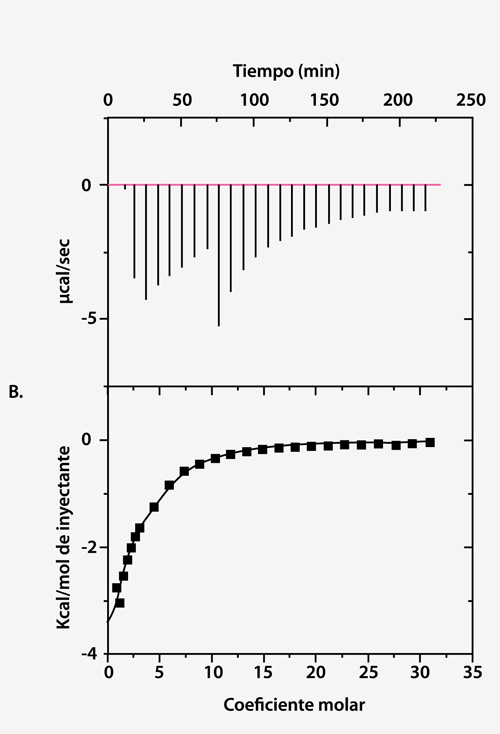
Fig 1. (A) Potencia diferencial (μcal/seg) versus tiempo de titulación de 50 mM de polisorbato-80 en 25 mg/ml de ProX, medido por ITC. El volumen de las inyecciones 9 a 12 fue 3,8 veces mayor comparado con las inyecciones 1 a8. (B) Calor por inyección en base a la integración de datos de la parte (A).
De acuerdo con la isoterma (Fig. 1), se concluye que los sitios de enlace de polisorbato-80 en ProX se saturaron a un coeficiente molar de polisorbato-80 por molécula de ProX de aproximadamente 10. La concentración micelar crítica (cmc) de polisorbato-80 es de 0,012 mM en agua pura, y se ha reportado un valor máximo de 0,1 mM en soluciones de proteínas (2). La concentración de polisorbato-80 en el experimento de ITC de la Figura 1 se extendió de 0,1 a 7 mM, por encima de la cmc, incluso después de la primera inyección. Esta información resulta importante, ya que cualquier interacción detectable se atribuiría a la unión de la proteína a las micelas del surfactante y no al monómero.
El conocimiento de los parámetros de enlace es útil para el desarrollo de formulaciones a fin de determinar la menor concentración posible de excipiente enlazado necesario para ‘saturar’ la proteína y alcanzar el efecto estabilizador. Minimizar la concentración del excipiente en la formulación reduce los costos y también el nivel de aditivos que se administrará al paciente. En este estudio de caso en particular, un exceso molar de 10 veces de polisorbato-80 por molécula de proteína fue suficiente para lograr la saturación de la misma. Los parámetros de enlace también sirven para predecir el comportamiento in-vivo del complejo proteína-excipiente. De este modo, las constantes débiles de afinidad de enlace medidas por ITC sugieren que el complejo ProX/polisorbato-80 se disociará debido a la dilución al ingresar en el torrente sanguíneo, sin tener efecto alguno en la actividad biológica de la droga proteica.
Interacción de ProX con fenol
El fenol se utiliza como agente antimicrobiano en la formulación de ProX. En esta oportunidad, se empleó la técnica ITC para evaluar la termodinámica de cualquier enlace mensurable entre la proteína y el agente conservante. El gráfico de la Figura 2 ilustra el calor por inyección versus el coeficiente molar para la titulación de 60 mM de fenol en 10 mg/ml de ProX a un pH de 5,7, 4,5 y 3,5, posterior a la sustracción de los experimentos de control.
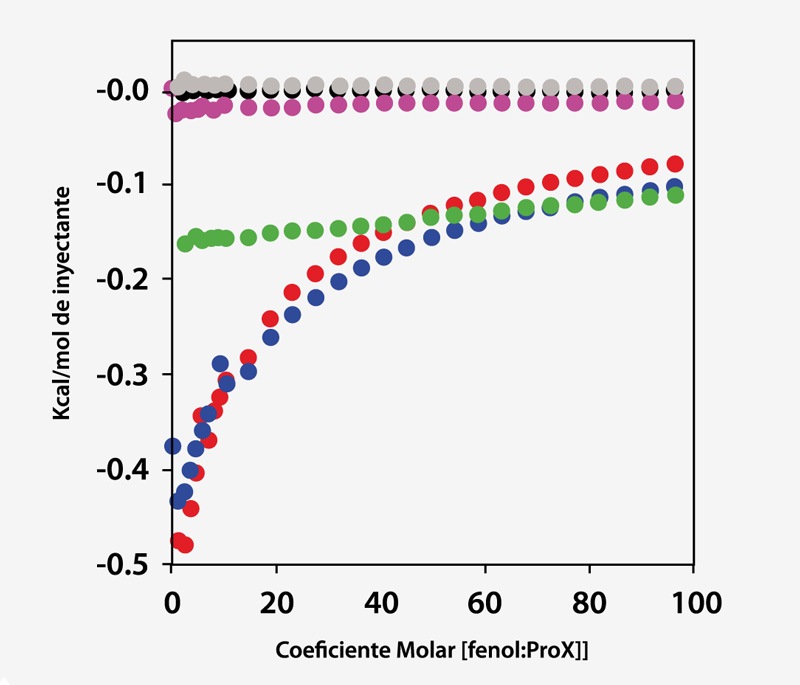
Fig. 2. Calor por inyección (medido por ITC) versus el coeficiente molar de fenol: ProX para titulación de 60 mM de fenol en 10 mg/ml de ProX en buffer de formulación correspondiente a un pH de 5,7 (rojo), 4,5 (azul) y 3,5 (verde) tras la sustracción de las corridas de control de buffer/buffer (negro), dilución de fenol (rosa) y dilución de ProX (gris).
Los datos de ITC muestran que a un pH de 5,7 y de 4,5,ProXinteractúa con el fenol, pero no lo hace a un pH de 3,5. Las isotermas resultantes no pudieron incluirse en ninguno de los modelos de enlace predefinidos, lo que indica que el evento de enlace es complejo y requiere de múltiples sitios.
La Figura 3 muestra los trazos de DSC para 1 mg/ml de ProX en los buffers de formulación idénticos a aquellos que se emplearon en los experimentos de ITC. Los datos DSC correspondientes muestran que, ante la ausencia de fenol a un pH de 5,7, ProX presentó al menos tres transiciones de despliegue con temperaturas en el punto medio de despliegue Tm1, Tm2, Tm3 equivalentes a 59°C, 68°C y 85°C, respectivamente; y la transición intermedia representó el principal evento de despliegue. La entalpía total de despliegue (ΔHdes) fue de 270 kcal/mol. A un pH de 4,5, no se pudo detectar la primera transición. El principal evento de despliegue presentó una Tm2 equivalente a 55 °C, y la Tm3disminuyó a 73 °C.
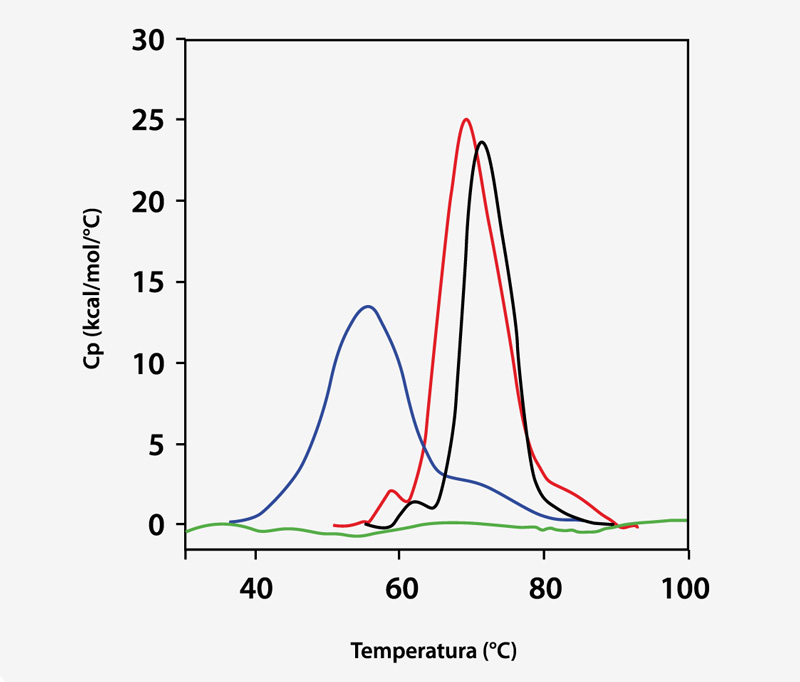
Fig 3. Capacidad calórica versus temperatura (medida por DSC) para 1 mg/ml de ProX en buffer de formulación con 0,005% (v/v) de fenol a un pH de 5,7 (negro), y con 0% de fenol a un pH de 5,7 (rojo), 4,5 (azul) y 3,5 (verde). Los datos presentados son posteriores a la sustracción de las corridas buffer/buffer y los niveles iniciales previos y posteriores a la transición.
La ΔHdes se redujo a 216 kcal/mol, lo que sugiere una disminución en la fuerza de las interacciones terciarias. Por último, a un pH de 3,5, ProX se desplegó por efecto ácido tal como lo indica la ausencia de transiciones de despliegue detectables en los datos DSC.
La Figura 3 también presenta el termograma DSC del despliegue de ProX en presencia de fenol a un pH de 5,7. Es importante mencionar que el fenol aumentó Tm1 en 1°C y Tm2 en 2°C,y disminuyóΔHdesa 195 kcal/mol. Sin embargo, la estructura terciaria de ProX permaneció igual en presencia y ausencia de fenol (determinada mediante datos de caracterización biofísica adicionales como fluorescencia, que no se muestran en el presente documento).En general, los cambios en el comportamiento de DSC se pueden correlacionar con los cambios en la estructura utilizando otros métodos. Sin embargo, esto no siempre sucede. Se cree que los cambios en DSC se originan a partir de la disrupción de las fuerzas que estabilizan la estructura proteica nativa (como van der Waals, interacciones hidrofóbicas y electroestáticas, enlaces de hidrógenos, etc.) y la hidratación de los residuos expuestos. La desestabilización de las interacciones terciarias podría disminuir la compactación de la proteína, que se detecta por DSC, sin inducir cambios estructurales que pueden detectarse por otros métodos analíticos.
La combinación de datos ITC y DSC reveló información significativa sobre las interacciones entre el fenol y la proteína. En primer lugar, el fenol se enlaza al ProX plegado, pero no se enlaza al ProX desplegado (Fig 2). Por lo tanto, es importante que la estructura terciaria permanezca intacta para que ProX encuentre sitios de enlace disponibles para el fenol. En segundo lugar, dado que es crítico que la estructura terciaria proteica permanezca intacta para su funcionamiento, el pH 5,7 parece ser el pH de formulación óptima.
En tercer lugar, como se observa en la Figura 2, el enlace del fenol al ProX alcanza la saturación completa en coeficientes molares superiores a 50. En cuarto lugar, la prueba DSC (1 mg/ml de ProX en buffer de formulación a un pH de 5,7 que contiene 0,005% (v/v) de fenol) se realizó a un coeficiente molar fenol: ProX estimado de 38, que se acercó a la saturación completa sin alcanzarla. En quinto lugar, aunque los sitios de enlace no se saturaron, dicho coeficiente molar fue suficiente para aumentar la estabilidad térmica de ProX.
El fenol demostró alcanzar menor actividad antimicrobiana en presencia de ProX (no se presentan los datos). Esta observación, además de saber que el fenol se enlaza a ProX, indica que el fenol enlazado posee poca o ninguna actividad antimicrobiana en comparación con el fenol no enlazado. De acuerdo con la curva de enlaces, se podría seleccionar una concentración de fenol por encima del punto de saturación-enlace para la formulación, donde la concentración del fenol no enlazado permitiría una actividad antimicrobiana efectiva. No se estimaron inicialmente los valores aumentados de Tm para ProX en presencia de fenol. Sin embargo, pareciera mostrar una mejor estabilidad térmica y una mayor estabilidad a largo plazo de la proteína. No es posible realizar una correlación directa entre la estabilización inducida por fenol, y la efectividad antimicrobiana del fenol.

Conclusión
La calorimetría de titulación isotérmica (ITC) y la calorimetría de barrido diferencial (DSC) lograron identificar y caracterizar de manera termodinámica el enlace del fenol al ProX plegado a un pH de 5,7, y del polisorbato-80 al ProX. La constante de enlace medida del ProX al polisorbato-80 clasifica la interacción como débil. De este modo, sería posible predecir la disociación in vivo de la proteína activa de los excipientes estabilizadores en la formulación, con una interferencia mínima inducida por los excipientes en el efecto biológico total de la droga proteica.
De acuerdo con la curva de saturación de las titulaciones ProX-fenol, es posible identificar una concentración de fenol por encima del punto de saturación a fin de crear una formulación que posea capacidad antimicrobiana óptima y mejorada estabilidad térmica. No solo se confirmó la hipótesis sobre el enlace de los excipientes, sino también se identificaron las concentraciones adecuadas de ambos excipientes (un exceso molar de 10 veces de polisorbato-80 por molécula de ProX en concentraciones superiores a cmc, y un exceso molar de 50 veces de fenol por molécula de ProX).
La seguridad y la eficacia son parte importante de los requerimientos de las formulaciones de productos proteicos. El agregado de excipientes con el fin de crear terapias proteicas seguras y eficaces, y de mejorar la estabilidad y vida útil del producto exige comprender las interacciones que se producen entre la proteína y los excipientes a nivel molecular. En esta nota de aplicación, los métodos ITCy DSC permitieron la caracterización del enlace proteína-excipiente como una de las muchas interacciones posibles de una compleja formulación de solución proteica.
Referencias
- Arakawa, T., et al, Factors affecting short-term and long-term stabilities of proteins. Adv. DrugDeliv. Rev. 46, 307-326 (2001).
- Chou, D. K., et al, Effects of Tween 20 and Tween 80 on the stability of Albutropin during agitation. J. Pharm. Sci. 94, 1368-1381 (2005).
- Bam, N. B., et al, Tween protects recombinant human growth hormone against agitation-induced damage via hydrophobic interactions J. Pharm. Sci. 87, 1554-1559 (1998).
- Ren, X., et al, Pharmaceutical excipients inhibit cytochrome P450 activity in cell free systems and after systemic administration. Eur. Jour. Pharm. Biopharm. 70, 279-288 (2008).
- Taheri-Kafrani, A., et al, T. Beta-lactoglobulin structure and retinol binding changes in presence of anionic and neutral detergents. J. Agric. FoodChem. 56, 7528-7534 (2008).














