
Método analítico para la determinación de HAP en la infusión de yerba mate

Los hidrocarburos aromáticos policíclicos (HAP) son compuestos tóxicos que se encuentran en algunos alimentos, en especial aquellos cuya preparación atraviesa un proceso ahumado, asado, grillado, o de secado. Existe un interés especial por la infusión de yerba mate (Ilex paraguariensis), debido a niveles relativamente altos de HAP y a su asociación aparente con problemas de salud.
Si bien los clásicos métodos de extracción de muestras arrojan excelentes resultados para detectar HAP en infusiones, estas técnicas exigen mucho tiempo y dinero. Se ha desarrollado un método de extracción QuEChERS modificado y de extracción en fase sólida (SPE) sobre sílice para la limpieza de muestras, que emplea menos recursos y alcanza una buena recuperación cuantitativa de HAP en la infusión de yerba mate. La separación cromatográfica de los compuestos HAP4 de la Autoridad Europea de Seguridad Alimentaria (EFSA) y de las interferencias isobáricas se optimizó en una fase estacionaria con alto contenido de fenilo empleando GC-TOFMS con gas transportador de hidrógeno y GC-MS/MS. La comparación de los valores de HAP obtenidos y determinados mediante GC-TOFMS y GC-MS/MS, fue favorable. Los niveles totales de los compuestos HAP4 de EFSA resultaron relativamente altos en relación con otros alimentos, arrojando una variación de 200 a 800 ng/g en la infusión seca.
Introducción
La yerba mate es muy popular en Argentina, Brasil, Paraguay y Uruguay, y su historia data de mucho tiempo en algunas culturas; aún hoy el mate se comparte entre varias personas como demostración de hospitalidad [1]. La importancia económica del mate aumenta a medida que se introducen en todo el mundo productos fabricados a partir del mate y su infusión. Su creciente popularidad se debe, en parte, a su reputación de brindar numerosos beneficios para la salud, que incluyen mayor energía y pérdida de peso, como así también para el tratamiento de varios problemas de salud, desde dolores de cabeza hasta hipertensión [2-7]. Sin embargo, existe una alta incidencia de cáncer esofágico en poblaciones que presentan un alto consumo de esta infusión, lo que sugiere un posible vínculo entre el mate y el cáncer [8-20]. Algo que debemos tener en cuenta son los niveles relativamente altos de HAP en la infusión de mate, que probablemente se deban a su proceso de secado en llamas u otro método similar [8].
Los hidrocarburos aromáticos policíclicos se forman durante el proceso de combustión, lo que despierta preocupación ya que algunos son tóxicos para el hombre. Los alimentos constituyen una vía común de exposición para los humanos, por lo que existen algunas reglamentaciones para ciertos alimentos y HAP específicos [21]. En el pasado se solía utilizar el benzo[a]pireno como único marcador de toxicidad. Sin embargo, los datos han demostrado la existencia de HAP tóxicos en los alimentos sin la presencia de benzo[a]pireno. La revisión realizada por la EFSA sugirió el monitoreo de al menos un subgrupo de cuatro HAP, HAP4, y de ocho HAP, HAP8, en los alimentos [21]. Los compuestos del grupo HAP4 incluyen benzo[a]pireno, criseno, benzo[a]antraceno y benzo[b]fluoranteno. El subgrupo HAP8 consiste en el grupo HAP4 además de benzo[k]fluoranteno, indeno[1,2,3-cd]pireno, dibenz[ah]antraceno y benzo[ghi]perileno. El desarrollo de métodos analíticos para detectar HAP debería ahora centrarse en estos subgrupos.
El análisis de los HAP es complejo debido a la existencia de HAP isobáricos que interfieren con los HAP de interés, lo que hace que la obtención precisa de una determinación cuantitativa resulte difícil, si no imposible de lograr. Por ejemplo, el criseno es un HAP tóxico y forma parte del grupo HAP4, pero su análisis se torna complejo debido a la presencia de trifenileno, una interferencia isobárica que se coeluye de forma completa o parcial al utilizar la cromatografía de gas. Esto provoca un sesgo en la concentración de criseno u obliga a elaborar un informe de los compuestos de manera conjunta. El problema es que el criseno es tóxico pero el trifenileno no lo es, por lo que a menudo se termina exagerando la toxicidad de los productos alimenticios. Por lo tanto, resulta esencial optimizar dicha separación y resolver los compuestos isobáricos a fin de brindar datos cuantitativos correctos para los compuestos de los grupos HAP4 y HAP8, que se emplean como marcadores de toxicidad.
El análisis de los HAP en productos alimenticios también presenta un desafío dado que los compuestos se deben determinar a niveles traza. Con frecuencia se realiza una preparación rigurosa de la muestra, que insume mucho tiempo, a fin de poder extraer los HAP, e incluye la limpieza de la muestra antes de su análisis. La naturaleza compleja de la infusión de mate ha llevado a los investigadores a utilizar exhaustivas preparaciones de muestras, entre las que podemos incluir la extracción con fluidos supercríticos [22], la extracción con fluidos presurizados [8] y la cromatografía de filtración en gel [23-25].
Los métodos de preparación de muestras QuEChERS son una alternativa atractiva, dado que son rápidos, fáciles y brindan resultados de calidad. Por lo general, estos métodos funcionan porque se los realiza junto con técnicas basadas en la espectrometría de masa, tal como la espectrometría de masa en tándem. Generalmente, el método QuEChERs consiste en una extracción de muestra seguida por una limpieza de la extracción en fase sólida dispersiva [26, 27]. Si bien al inicio el método QuEChERS fue diseñado para residuos de pesticidas en frutas y verduras [26], muchas modificaciones se han implementado a fin de ampliar su alcance original. En la actualidad también se evalúan otros compuestos como los HAP, los fármacos de uso veterinario, y los contaminantes orgánicos persistentes, que pueden emplear el método QuEChERS, y se han utilizado métodos similares a QuEChERS para evaluar productos básicos como té, especias y tabaco [28-40].
Este artículo describe el desarrollo de un método analítico para la determinación de HAP en infusiones, que permite a los analistas caracterizar los HAP objetivo de manera más rápida y precisa. La preparación de la muestra se basa en la extracción de QuEChERS modificada y en la limpieza de la muestra por extracción en fase sólida. Se emplearon las técnicas GC-TOFMS y GC-MS/MS y se optimizaron los análisis para resolver los compuestos isobáricos y lograr un tiempo de análisis razonable.
Técnica experimental
Materiales
El desarrollo de este método analítico para la determinación de HAP en las infusiones empleó seis marcas de yerba disponibles en el mercado. Todos los solventes fueron de grado LC-MS o superior. Los patrones y las fuentes de referencia fueron las siguientes: mezcla de HAP método EPA 8310, que contiene 18 HAP (cat.# 31874, Restek Corporation); 5-metilcriseno, benzo[c]fenantreno, benzo[j]fluoranteno, ciclopenta[cd]pireno y dibenzo[a,e]pireno (Cerilliant); coroneno, dibenz[a,c]antraceno, perileno y trifenileno (Sigma-Aldrich); benzo[e]pireno (Ultra Scientific); benzo(ghi)fluoranteno y benzo[a]fluoranteno (Santa Cruz Biotechnology). Si bien se evaluaron 30 HAP, se prestó especial atención a los grupos HAP4* y HAP8. La mezcla de patrones internos fue SV (cat.# 31206, Restek Corporation). También se utilizaron de Restek Corporation sales de extracción QuEChERS originales sin búfer (cat.# 23992) y cartuchos de extracción en fase sólida con fritas de PTFE de 500 mg de sílice (cat.# 24036).
Preparación de la muestra y extracción de QuEChERs modificada
La infusión seca se molió utilizando una mezcladora manual. La extracción QuEChERS requiere que la muestra tenga un alto contenido de agua (>80%). A fin de preparar el material seco para la extracción QuEChERS, por cada gramo de infusión en polvo se agregaron 10 ml de agua en un tubo de FEP. Después de agitar bien la mezcla, se agregaron los HAP y los patrones internos. Se fortificaron los HAP en 50 y 500 ng/g de infusión seca y se agregaron los patrones internos en 100 ng/g. Se maceraron las muestras 10 minutos y luego se agregaron 10 ml de hexano:acetona (1:1, v/v). Posteriormente, se agitaron las muestras por 30 minutos y se agregaron lentamente las sales de QuEChERS pre-envasadas sin búfer (4 g MgSO4 y 1 g NaCL). Las muestras se agitaron manualmente durante 1 minuto y luego se centrifugaron por 5 minutos a 3.000 x g. Se realizó una investigación de los solventes de extracción para determinar si el uso de acetonitrilo o hexano:acetona (1:1, v/v) obtenía mejores recuperaciones. El procedimiento descripto anteriormente fue empleado con algunas modificaciones. Se fortificaron dos gramos de infusión en polvo con 18 HAP a 50 µg/g (en infusión seca), empleando la mezcla de HAP método EPA 8310 (cat.# 31874). Las muestras fortificadas con HAP se maceraron durante la noche a aproximadamente 4 ºC para optimizar la introducción de los HAP en la infusión previo a su extracción. Luego, se procesaron las muestras con el método de extracción y limpieza QuEChERS descripto en este artículo. La Tabla I resume el procedimiento final de extracción optimizada.

* Desde la finalización de este artículo, Restek ha desarrollado material de referencia HAP4 certificado por EFSA (cat.# 32469), preparado en 1.000 µg/ml de tolueno, que resulta conveniente y compatible con los solventes QuEChERS.
Limpieza con extracción en fase sólida
Se produjo un intercambio de dos mililitros de extracto a hexano mediante la evaporación a menos de 1 ml, bajo una suave corriente de nitrógeno en bloque calentador a 50 ºC, agregando luego un volumen total de 2 ml de hexano. Este proceso se realizó dos veces. El cartucho de sílice se acondicionó con 3 ml de metanol seguido de 3 ml de acetona bajo un alto grado de vacío, luego con 3 ml de hexano:cloruro de metileno (1:1, v/v) y 6 ml de hexano a 1 gota por segundo aproximadamente. Se cargó un mililitro de extracto en el cartucho y se eluyó con 5 ml de diversos porcentajes de cloruro de metileno en hexano. Los solventes de elución evaluados tenían un volumen de 0, 15, 25, 50 y 75 por ciento de cloruro de metileno en hexano. Las muestras eluidas se concentraron a un volumen final de 1 ml en corriente de nitrógeno a 50 ºC. La Tabla I resume el procedimiento final de limpieza.

Tabla 1: Procedimiento final de extracción y limpieza Extracción QuEChERS modificada
Métodos de cromatografía de gases
Se utilizaron tres formatos de métodos cromatográficos optimizados: GC-FID, GC-TOFMS y GC-MS/MS. GC-FID fue empleado únicamente para las evaluaciones de los solventes de extracción. Las plataformas GC-TOFMS y GC-MS/MS se utilizaron para la recuperación de la concentración y el análisis cuantitativo de los HAP.
Cromatografía de gases-detección de ionización de llama
Se utilizó el método GC-FID (instrumento GCxGC-FID, LECO Corporation) a fin de evaluar los solventes de extracción. Se instaló una columna Rxi®-5Sil MS de 30 m x 0,25 mm x 0,25 µm (cat.# 13623, Restek Corporation), que operó con un flujo constante de helio a 2 ml/min. y un programa de horno de 80 ºC durante 0,1 min., que luego aumentó a 8,5 ºC/min. hasta 330 ºC y se mantuvo durante 0,49 min. La entrada permaneció a 300 ºC y se añadió un liner de entrada con lana Sky® 4.0 mm ID Precision® (cat.# 23305, Restek Corporation). Se inyectó un microlitro en una relación de división de 10:1. El detector FID se mantuvo a 350 ºC.
Cromatografía de gases-espectrometría de masas de tiempo de vuelo
Se utilizó un equipo de GC-TOFMS Pegasus III de LECO® (LECO Corporation) para realizar la separación y la cuantificación. La cromatografía de gases se realizó con columna Rxi®-PAH para GC de alto contenido de fenilo en una configuración de 60 m x 0,25 mm x 0,10 µm (cat.# 49317, Restek Corporation). Se efectuó una inyección sin división de 2,5 µL utilizando un liner de entrada Sky® 4 mm con lana y taper individual (cat.# 23303, Restek Corporation). La temperatura de entrada fue de 275 ºC. La válvula de purga splitless se ajustó a 1 min. Se empleó un flujo constante de hidrógeno a 2,4 ml/min. con una temperatura de horno de 80 ºC (durante 1 min.), aumentando a 40 ºC/min. hasta llegar a 210 ºC, luego a 3 ºC/min. hasta llegar a 260 ºC, luego a 11,5 ºC/min. hasta llegar a 350 ºC (durante 6,26 min.). El sistema TOFMS Pegasus III de LECO® operó a una temperatura fuente de 300 ºC, utilizó ionización de electrones a 70 eV y almacenó un rango de masa de 45 a 550 u con una velocidad de adquisición de 5 espectros/seg.

Cromatografía de gases-Espectrometría de masas en tándem (GC-MS/MS)
Se utilizó el equipo Thermo TSQ™ 8000 (Thermo Fisher Scientific) para realizar el análisis GC-MS/MS. El mismo incluía una columna Rxi®-PAH de 40 m x 0,18 mm x 0,07 µm (cat.# 49316, Restek Corporation), con flujo constante de helio a 1,4 ml/min. y taper individual de 2 mm con liner de entrada con lana (cat.# 23316, Restek Corporation). Se mantuvo la entrada a 275 ºC y el programa de horno a 80 ºC (durante 1 min.), luego a 37 ºC/min. hasta llegar a 210 ºC, luego a 3 ºC/min. hasta alcanzar 260 ºC, y después a 11 ºC/min. hasta llegar a 350 ºC (durante 5 min.). Se utilizó inyección splitless de 0,5 μL con tiempo splitless de 0,58 min. y una duración de carga de 0,6 min. La línea de transferencia se mantuvo a 330 ºC. Se recolectaron tres transiciones SRM por cada uno de los compuestos. El modo SRM no se empleó de la forma más habitual en la que se monitorean los fragmentos, sino que se utilizó para disminuir el ruido de fondo. Los HAP poseen una fuerte ionización molecular, por lo que se utilizan transiciones entre el ión molecular, [M]+•, en Q1 y los iones [M]+•, [M-H]+• y [M-2H] +• en Q3. La determinación cuantitativa se basó en una transición. La energía de emisión fue de 90 µA y la de colisión se estableció en 10.
Porcentaje de recuperación y determinación de HAP
Se prepararon muestras fortificadas a 500 ng/g (ppb) mediante el procedimiento optimizado de acondicionamiento de muestras descripto en la Tabla I. Los patrones internos empleados fueron acenafteno-d10, criseno-d12, naftaleno-d8, perileno-d12 y fenantreno-d10. Se asignaron los patrones internos a los analitos según el tiempo de retención más próximo a los analitos objetivo. A fin de obtener la determinación cuantitativa de las muestras fortificadas y no fortificadas se utilizó una curva de calibración de solventes con niveles de 50, 150, 500, 1000 y 2000 ppb.
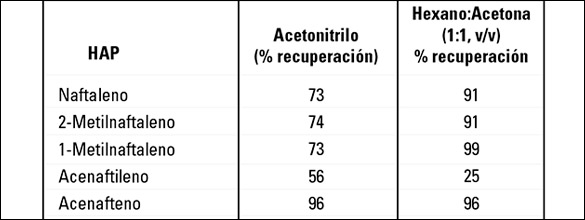
TABLA 2: Porcentaje de recuperación de HAP fortificados a 50 µg/g en una infusión de yerba mate. Los valores representados comparan acetonitrilo y hexano:acetona (1:1, v/v) como solventes de extracción empleados durante la extracción inicial de muestras de infusión húmeda de mate.
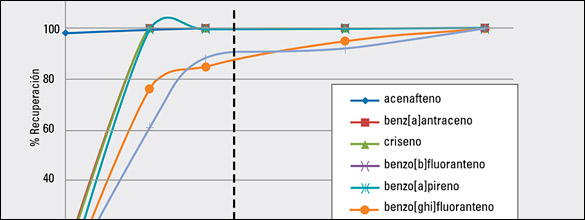
FIGURA 1: Porcentajes de recuperación de HAP de bajo, medio y alto peso molecular en relación con el porcentaje de cloruro de metileno en hexano empleado en la elución de SPE sobre sílice. Los HAP se fortificaron a 50 µg/g.
Resultados y consideraciones
Investigación sobre el solvente para extracción de muestras
QuEChERS constituye un método ideal para el procesamiento de muestras por ser rápido, fácil y económico. El abordaje inicial de QuEChERS empleado en el presente trabajo comenzó con la hidratación de la infusión seca y su posterior extracción con acetonitrilo, para luego finalizar con el particionamiento mediante el agregado de sales. El paso de hidratación es importante para las extracciones QuEChERS, dado que es necesario para obtener el particionamiento correcto [41, 42]. En general, se utiliza acetonitrilo para dichas extracciones por ser un solvente efectivo para los pesticidas y obtiene una menor cantidad de material de co-extracción para algunas matrices [41, 43]. Sin embargo, la solubilidad y la recuperación de los HAP empleando acetonitrilo como solvente de extracción resultaron problemáticas. Conforme a los resultados de la investigación sobre solventes de extracción, el hexano:acetona (1:1, v/v) resulta un solvente de extracción más potente para HAP y, por ende, se lo utilizó en lugar de acetonitrilo para los experimentos restantes.
La Tabla II muestra los valores de recuperación de HAP en muestras de infusión de mate fortificadas a 50 µg/g y procesadas con acetonitrilo y hexano:acetona. La tendencia general muestra una menor recuperación de HAP con acetonitrilo comparada con la recuperación mediante hexano:acetona (1:1, v/v). Esto es de esperar ya que existe una inconsistencia de polaridad entre los HAP, los compuestos no polares y el acetonitrilo, que es un solvente polar. Los valores de recuperación que se obtuvieron con el acetonitrilo también mostraron una tendencia de recuperación progresivamente menor en el caso de los HAP de mayor peso molecular. Esto se puede atribuir a la menor solubilidad de los HAP de alto peso molecular en comparación con los análogos de menor peso molecular. Los valores de recuperación de los HAP objetivo utilizando hexano:acetona (1:1, v/v) como solvente de extracción se encuentran en el rango aceptable y no se observan sesgos para los HAP de alto peso molecular. En todos los experimentos posteriores se utilizó hexano:acetona (1:1, v/v) como solvente de extracción.

Evaluación del porcentaje de cloruro de metileno en solvente de hexano para la limpieza de muestras
Los productos básicos como las infusiones y las especias pueden presentar un gran desafío por ser matrices muy complejas. Es necesario realizar una limpieza de las muestras a fin de eliminar el material de co-extracción y prepararlas para su análisis. Las técnicas integrales de limpieza pueden reducir en gran medida el número y la cantidad de compuestos de co-extracción [44, 45]. Sin embargo, a menudo estos métodos son procedimientos que demandan mucho tiempo y esfuerzo.
La estrategia para este trabajo fue desarrollar un procedimiento de limpieza simple que elimine suficiente material de co-extracción para permitir un análisis exitoso, pero que también minimice los recursos necesarios para realizar la limpieza. Los sistemas de cromatografía de gases pueden dañarse rápidamente si se introducen muestras que posean gran cantidad de material no volátil. Este material se deposita en la entrada del cromatógrafo de gases y ensucia el liner de entrada y las juntas. La cabeza de la columna también puede contaminarse con material no volátil que no puede eluirse de la columna. Este escenario requiere del mantenimiento del instrumento y de la columna.
La limpieza en SPE sobre sílice fue optimizada en relación con el solvente de elución y el volumen. Los HAP pueden eluirse con una combinación de hexano y cloruro de metileno. Se evaluaron las muestras de infusión fortificadas a 50 µg/g, utilizando diversos solventes de elución con bajos y altos porcentajes de cloruro de metileno. La Figura 1 muestra el porcentaje de recuperación respecto del porcentaje de cloruro de metileno en hexano para HAP de bajo, medio y alto peso molecular. El acenafteno es de bajo peso molecular y se eluyó fácilmente con hexano. Sin embargo, los compuestos de mayor peso molecular requirieron un solvente más potente para eluirse del sílice. Los trazos de los HAP individuales muestran una mayor recuperación al aumentar la relación de cloruro de metileno. Con un 15% de cloruro de metileno en hexano, los HAP de tamaño medio, como el HAP4 que se ilustra en la Figura 1, logran una buena recuperación con valores cercanos al 100%. Sin embargo, los HAP más grandes como el coroneno solo logran una recuperación del 60% aproximadamente. En base a los valores de recuperación, se decidió utilizar 30% de cloruro de metileno en hexano para trabajos posteriores. Esta composición de solvente de elución arrojó una recuperación aceptable para todos los HAP objetivo. Una mayor relación de cloruro de metileno mejoraría la recuperación de los HAP más grandes, pero también aumentaría la cantidad de material de co-extracción.
Optimizar la separación cromatográfica es fundamental para el análisis de los HAP debido a los compuestos isobáricos que generalmente coeluyen y dificultan la determinación cuantitativa. Se desarrolló un método optimizado de cromatografía de gases, utilizando una columna Rxi®-PAH de alto contenido de fenilos selectiva para los HAP altamente aromáticos. Debido a la selectividad de la fase estacionaria de la columna y a los formatos de columna, el análisis de los 30 HAP utilizados en el estudio, incluidos los dibenzopirenos, se completó en 35 minutos, un tiempo de análisis relativamente rápido.
La figura 2A muestra un cromatograma de iones extraídos de m/z 226 y 228 para la infusión comercial 1, que se obtuvo con el método de GC-TOFMS descripto anteriormente. La separación del trifenileno y de criseno arroja picos distintivos. Esto permitió una confiable integración de los picos para ambos compuestos, que son congéneres isobáricos que usualmente elucionan al mismo o casi al mismo tiempo de retención. De modo similar, el benzo[b]fluoranteno, el benzo[j]fluoranteno y el benzo[k]fluoranteno son difíciles de separar, aunque es posible resolverlos correctamente como lo ilustra la Figura 2B.
En total, el método optimizado que se utilizó para este trabajo logró separar pares críticos y permitió una determinación cuantitativa precisa e independiente de los principales marcadores de toxicidad, incluidos el criseno y el benzo[b]fluoranteno, que son compuestos PAH4 de EFSA y dibenz[a,h]antraceno, que es un compuesto PAH8.
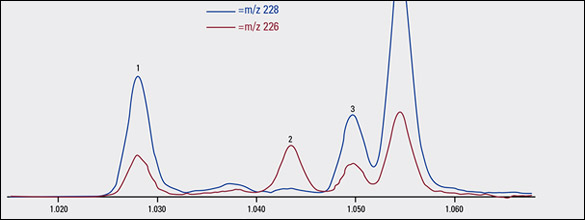
FIGURA 2A: Cromatograma de iones extraídos por GC-TOFMS de m/z 226 y 228, que muestra la separación de HAP detectados, incluidos trifenileno y criseno, de la infusión comercial
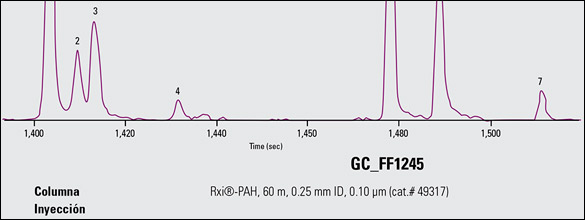
FIGURA 2B: Cromatograma de iones extraídos por GC-TOFMS de m/z 252, que muestra la separación de benzofluorantenos detectados de la infusión comercial 1.
HAP detectados en las infusiones
El análisis cuantitativo se completó fácilmente a través del método cromatográfico optimizado. Se evaluaron los valores detectados de los compuestos isobáricos en seis infusiones de mate comerciales, cuyos resultados se describen en la Tabla III. Se demuestra el sesgo cuantitativo al comparar las concentraciones de los compuestos en cada par isobárico, que se agrupan entre filas color gris.
De acuerdo con los valores de la Tabla III, el criseno presentaría un sesgo de alrededor del 20%, el benzo[b]fluoranteno en aproximadamente un 50%, y el dibenzo[a,h]antraceno en un 60% si tuviera que informarse el área combinada de los pares. La capacidad de separar estos compuestos resulta crítica para determinar la presencia y concentración de los HAP marcadores de toxicidad.
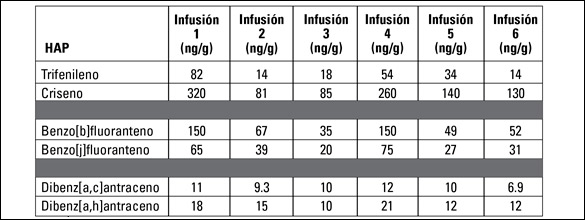
Tabla III: Valores de HAP detectados en seis infusiones de mate distintas, determinados mediante el método de extracción/limpieza final y el análisis GC-TOFMS. Los pares isobáricos se agrupan y se separan por la fila de color gris de la tabla.
Recuperación de HAP en infusiones fortificadas
Para el método optimizado se empleó la extracción QuEChERS modificada con hexano:acetona (1:1, v/v), limpieza SPE sobre sílice, y una columna de GC Rxi®-PAH selectiva. Tanto la GC-MS/MS como la GC-TOFMS fueron capaces de realizar el método y arrojaron valores de recuperación satisfactorios, pero la GC-MS/MS mostró una mejor sensibilidad. Los valores de recuperación se describen en la Tabla IV.
Los valores de recuperación de todos los HAP del estudio varían de 72% a 130%, con solo cuatro compuestos que se encuentran entre el 70% y 80%. La recuperación de los compuestos PAH4 de ESFA rondó el 81-100% y los valores de recuperación de los compuestos PAH8 de EFSA se establecieron entre el 81% y 110%. Los valores de recuperación indican que este método analítico para la determinación de HAP en las infusiones es apropiado para los HAP que presentan un amplio rango de volatilidad y peso molecular.
Tabla IV: Porcentaje de recuperación de HAP en una infusión comercial. Los HAP se fortificaron a 500 µg/g de infusión seca.
Comparación de GC-TOFMS y GC-MS/MS para compuestos PAH4 de EFSA
Se procesaron muestras de seis infusiones de yerba mate con el método optimizado de preparación de muestras y dos métodos basados en GC-MS. El método GC-TOFMS utilizó una columna de GC Rxi®-PAH selectiva en una configuración de 60 m x 0,25 mm x 0,10 µm (cat.# 49317), que aumenta la separación de los compuestos isobáricos al igual que la capacidad de carga de las muestras.
Se mejoró la resolución de picos mediante el uso de hidrógeno como gas transportador. Es ideal el análisis de los HAP mediante GC-MS con hidrógeno como arrastre, dado que forman fuertes iones moleculares y no sufren reactividad del hidrógeno, mitigando de ese modo la potencial pérdida de sensibilidad al utilizar hidrógeno en GC-MS. El método de GC-MS/MS también empleó la columna de GC Rxi®-PAH selectiva, pero con un formato de 40 m x 0,18 mm x 0,07 µm (cat.# 49316), que logra el equilibrio entre la separación y el tiempo de análisis. Además, la carga de muestras es más pequeña dado que el espesor de lámina de la fase estacionaria es relativamente delgado.
Por lo tanto, fue importante reducir el volumen de inyección de muestras para este método. Las muestras de yerba mate presentaron concentraciones de HAP relativamente elevadas, por lo que utilizar una inyección de 0,5 µL no afectó la detectabilidad total. Sin embargo, para otros productos básicos con niveles de trazas de HAP, utilizar una MS tándem de elevada sensibilidad puede compensar los bajos volúmenes de inyección.
Las concentraciones de los compuestos PAH4 detectados se determinaron mediante GC-TOFMS y GC-MS/MS y aparecen en la Tabla V. Los niveles combinados de PAH4 se describen en la última fila. Los valores definidos mediante ambas técnicas coinciden, lo que indica que tanto la preparación de muestras como los métodos de análisis son apropiados para el análisis de HAP en infusiones de yerba mate.
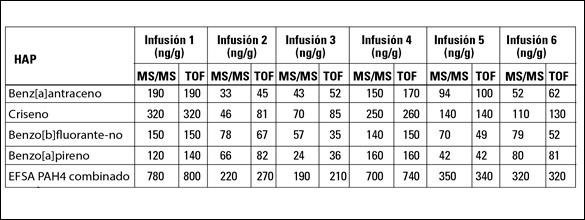
Tabla V: Concentraciones detectadas, ng/g de infusión seca, de los compuestos PAH4 en seis marcas de yerba mate. Por cada infusión, se indican los valores de los métodos GC-MS/MS y GC-TOFMS. Las concentraciones combinadas de PAH4 se detallan en la última fila.
Conclusión
Las infusiones de mate evaluadas presentan altos niveles de HAP al compararlas con el límite residual promedio que varía de 1 a 10 ng/g. La combinación de PAH4 de EFSA se describe en la última fila de la Tabla V y varía de 190 a 800 ng/g en infusión seca. El método optimizado de preparación de muestras para la determinación de HAP en infusiones de yerba mate arrojó una recuperación satisfactoria de todos los HAP evaluados. Los métodos cromatográficos selectivos se complementaron con la detección basada en MS.
Se alcanzó una separación suficiente de HAP isobáricos mediante columnas Rxi®-PAH con una fase estacionaria selectiva para HAP, que realiza la determinación cuantitativa de los HAP individuales de forma directa. En términos generales, este método analítico para determinar HAP en infusiones demandó menos recursos y tiempo que lo que se requiere por lo general para el análisis de una matriz compleja como la infusión de yerba mate al tiempo que otorgó una mejor calidad de los datos.
Referencias
[1] Guayakí. Mate Gourd Ceremony. http://guayaki.com/mate/2611/Mate-Gourd-Ceremony.html (Accessed June 28, 2013).
[2] D. H. M. Bastos, D. M. d. Oliveira, R. L. T. Matsumoto, P. d. O. Carvalho, M. L. Ribeiro, Yerba maté: Pharmacological Properties, Research and Biotechnology, Medicinal and Aromatic Plant Science and Biotechnology 1 (2007) 37.
[3] R. L. Matsumoto, S. Mendonca, D. M. de Oliveira, M. F. Souza, D. H. Bastos, Effects of mate tea intake on ex vivo LDL peroxidation induced by three different pathways, Nutrients 1 (2009) 18.
[4] M. Bixby, L. Spieler, T. Menini, A. Gugliucci, Ilex paraguariensis extracts are potent inhibitors of nitrosative stress: a comparative study with green tea and wines using a protein nitration model and mammalian cell cytotoxicity, Life Sci. 77 (2005) 345.
[5] H. Gao, Y. Long, X. Jiang, Z. Liu, D. Wang, Y. Zhao, D. Li, B. L. Sun, Beneficial effects of Yerba Mate tea (Ilex paraguariensis) on hyperlipidemia in high-fat-fed hamsters, Exp. Gerontol. 48 (2013) 572.
[6] F. Martins, A. J. Suzan, S. M. Cerutti, D. P. Arcari, M. L. Ribeiro, D. H. Bastos, O. Carvalho Pde, Consumption of mate tea (Ilex paraguariensis) decreases the oxidation of unsaturated fatty acids in mouse liver, Br. J. Nutr. 101 (2009) 527.
[7] P. E. Resende, S. G. Verza, S. Kaiser, L. F. Gomes, L. C. Kucharski, G. G. Ortega, The activity of mate saponins (Ilex paraguariensis) in intra-abdominal and epididymal fat, and glucose oxidation in male Wistar rats, J. Ethnopharmacol. 144 (2012) 735.
[8] F. Kamangar, M. M. Schantz, C. C. Abnet, R. B. Fagundes, S. M. Dawsey, High levels of carcinogenic polycyclic aromatic hydrocarbons in mate drinks, Cancer Epidemiol. Biomarkers Prev. 17 (2008) 1262.
[9] V. Sewram, E. D. Stefani, P. Brennan, P. Boffetta, Maté Consumption and the Risk of Squamous Cell Esophageal Cancer in Uruguay, Cancer Epidemiology, Biomarkers & Prevention 12 (2003) 508.
[10] M. N. Bates, C. Hopenhayn, O. A. Rey, L. E. Moore, Bladder cancer and mate consumption in Argentina: a case-control study, Cancer Lett. 246 (2007) 268.
[11] R. Castelletto, X. Castellsague, N. Munoz, J. Iscovich, N. Chopita, A. Jmelnitsky, Alcohol, tobacco, diet, mate drinking, and esophageal cancer in Argentina, Cancer Epidemiol. Biomarkers Prev. 3 (1994) 557.
[12] X. Castellsague, N. Munoz, E. De Stefani, C. G. Victora, R. Castelletto, P. A. Rolon, Influence of mate drinking, hot beverages and diet on esophageal cancer risk in South America, Int. J. Cancer 88 (2000) 658.
[13] A. P. Dasanayake, A. J. Silverman, S. Warnakulasuriya, Mate drinking and oral and oro-pharyngeal cancer: a systematic review and meta-analysis, Oral Oncol. 46 (2010) 82.
[14] E. De Stefani, P. Correa, L. Fierro, E. Fontham, V. Chen, D. Zavala, Black tobacco, mate, and bladder cancer. A case-control study from Uruguay, Cancer 67 (1991) 536.
[15] E. De Stefani, L. Fierro, P. Correa, E. Fontham, A. Ronco, M. Larrinaga, J. Balbi, M. Mendilaharsu, Mate drinking and risk of lung cancer in males: a case-control study from Uruguay, Cancer Epidemiol. Biomarkers Prev., 5 (1996) 515.
[16] E. De Stefani, L. Fierro, M. Mendilaharsu, A. Ronco, M. T. Larrinaga, J. C. Balbi, S. Alonso, H. Deneo-Pellegrini, Meat intake, ‘mate’ drinking and renal cell cancer in Uruguay: a case-control study, Br. J. Cancer 78 (1998) 1239.
[17] D. Goldenberg, Mate: a risk factor for oral and oropharyngeal cancer, Oral Oncol. 38 (2002) 646.
[18] D. Loria, E. Barrios, R. Zanetti, Cancer and yerba mate consumption: a review of possible associations, Rev Panam Salud Publica 25 (2009) 530.
[19] P. A. Rolon, X. Castellsague, M. Benz, N. Munoz, Hot and cold mate drinking and esophageal cancer in Paraguay, Cancer Epidemiol. Biomarkers Prev. 4 (1995) 595.
[20] V. Sewram, E. De Stefani, P. Brennan, P. Boffetta, Mate consumption and the risk of squamous cell esophageal cancer in uruguay, Cancer Epidemiol. Biomarkers Prev. 12 (2003) 508.
[21] Scientific Opinion of the Panel on Contaminants in the Food Chain on a request from the European Commission on Polycyclic Aromatic Hydrocarbons in Food, The EFSA Journal 724 (2008) 1.
[22] S. Schlemitz, W. Pfannhauser, Supercritical fluid extraction of mononitrated polycyclic aromatic hydrocarbons from tea – correlation with the PAH concentration, Zeitschrift für Lebensmitteluntersuchung und -Forschung A 205 (1997) 305.
[23] M. Ciecierska, M. W. Obiedzinski, Polycyclic aromatic hydrocarbons in the bakery chain, Food Chem. 141 (2013) 1.
[24] B. Dusek, J. Hajslova, V. Kocourek, Determination of nitrated polycyclic aromatic hydrocarbons and their precursors in biotic matrices, J. Chromatogr. A, 982 (2002) 127.
[25] W. Jira, K. Ziegenhals, K. Speer, Gas chromatography-mass spectrometry (GC-MS) method for the determination of 16 European priority polycyclic aromatic hydrocarbons in smoked meat products and edible oils, Food Addit. Contam. Part A Chem. Anal. Control Expo. Risk Assess. 25 (2008) 704.
[26] M. Anastassiades, S. J. Lehotay, D. Stajnbaher, F. J. Schenck, Fast and Easy Multiresidue Method Employing Acetonitrile Extraction/Partitioning and “Dispersive Solid-Phase Extraction” for the Determination of Pesticide Residues in Produce, J. AOAC International 83 (2003)
[27] S. J. Lehotay, K. Mastovska, A. R. Lightfield, Use of buffering and other means to improve results of problematic pesticides in a fast and easy method for residue analysis of fruits and vegetables, J. AOAC Int. 88 (2005) 615.
[28] P. Yogendrarajah, C. Van Poucke, B. De Meulenaer, S. De Saeger, Development and validation of a QuEChERS based liquid chromatography tandem mass spectrometry method for the determination of multiple mycotoxins in spices, J. Chromatogr. A 1297 (2013) 1.
[29] H. Yan, X. Liu, F. Cui, H. Yun, J. Li, S. Ding, D. Yang, Z. Zhang, Determination of amantadine and rimantadine in chicken muscle by QuEChERS pretreatment method and UHPLC coupled with LTQ Orbitrap mass spectrometry, J. Chromatogr. B Analyt. Technol. Biomed. Life Sci. 938C (2013) 8.
[30] I. M. Valente, C. M. Santos, M. M. Moreira, J. A. Rodrigues, New application of the QuEChERS methodology for the determination of volatile phenols in beverages by liquid chromatography, J. Chromatogr. A 1271 (2013) 27.
[31] S. Shoeibi, M. Amirahmadi, H. Rastegar, R. Khosrokhavar, A. M. Khaneghah, An applicable strategy for improvement recovery in simultaneous analysis of 20 pesticides residue in tea, J. Food Sci. 78 (2013) T792.
[32] A. Sadowska-Rociek, M. Surma, E. Cieslik, Application of QuEChERS method for simultaneous determination of pesticide residues and PAHs in fresh herbs, Bull. Environ. Contam. Toxicol. 90 (2013) 508.
[33] W. Peysson, E. Vulliet, Determination of 136 pharmaceuticals and hormones in sewage sludge using quick, easy, cheap, effective, rugged and safe extraction followed by analysis with liquid chromatography-time-of-flight-mass spectrometry, J. Chromatogr. A, 1290 (2013) 46.
[34] F. Lega, L. Contiero, G. Biancotto, R. Angeletti, Determination of thyreostats in muscle and thyroid tissues by QuEChERS extraction and ultra-performance liquid chromatography tandem mass spectrometry, Food Addit. Contam. Part A Chem. Anal. Control Expo. Risk Assess. (2013)
[35] V. Homem, J. Avelino Silva, C. Cunha, A. Alves, L. Santos, New analytical method for the determination of musks in personal care products by Quick, Easy, Cheap, Effective, Rugged, and Safe extraction followed by GC-MS, J. Sep. Sci. (2013)
[36] A. Albinet, S. Tomaz, F. Lestremau, A really quick easy cheap effective rugged and safe (QuEChERS) extraction procedure for the analysis of particle-bound PAHs in ambient air and emission samples, Sci. Total Environ. 450-451 (2013) 31.
[37] M. Amirahmadi, S. Shoeibi, M. Abdollahi, H. Rastegar, R. Khosrokhavar, M. P. Hamedani, Monitoring of some pesticides residue in consumed tea in Tehran market, Iranian J. Environ. Health Sci. Eng. 10 (2013) 9.
[38] K. Usui, Y. Hayashizaki, M. Hashiyada, M. Funayama, Rapid drug extraction from human whole blood using a modified QuEChERS extraction method, Leg. Med. (Tokyo) 14 (2012) 286.
[39] J. W. Shi, Y. G. Zhao, Z. J. Fu, J. G. Li, Y. F. Wang, T. C. Yang, Development of a screening method for the determination of PCBs in water using QuEChERS extraction and gas chromatography-triple quadrupole mass spectrometry, Anal. Sci. 28 (2012) 167.
[40] K. Mastovska, K. J. Dorweiler, S. J. Lehotay, J. S. Wegscheid, K. A. Szpylka, Pesticide multiresidue analysis in cereal grains using modified QuEChERS method combined with automated direct sample introduction GC-TOFMS and UPLC-MS/MS techniques, J. Agric. Food Chem. 58 (2010) 5959.
[41] I. R. Pizzutti, A. de Kok, M. Hiemstra, C. Wickert, O. D. Prestes, Method validation and comparison of acetonitrile and acetone extraction for the analysis of 169 pesticides in soya grain by liquid chromatography-tandem mass spectrometry, J. Chromatogr. A, 1216 (2009) 4539.
[42] K. Maštovská, S. J. Lehotay, Evaluation of common organic solvents for gas chromatographic analysis and stability of multiclass pesticide residues, J. Chromatogr. A 1040 (2004) 259.
[43] Z. Huang, Y. Li, B. Chen, S. Yao, Simultaneous determination of 102 pesticide residues in Chinese teas by gas chromatography-mass spectrometry, J. Chromatogr. B Analyt. Technol. Biomed. Life Sci. 853 (2007) 154.
[44] G. F. Pang, Y. M. Liu, C. L. Fan, J. J. Zhang, Y. Z. Cao, X. M. Li, Z. Y. Li, Y. P. Wu, T. T. Guo, Simultaneous determination of 405 pesticide residues in grain by accelerated solvent extraction then gas chromatography-mass spectrometry or liquid chromatography-tandem mass spectrometry, Anal. Bioanal. Chem. 384 (2006) 1366.











