Mitigar el «efecto matriz»: Estrategias de dilución, QuEChERS y calibración para el análisis LC-MS/MS de residuos de plaguicidas en distintos alimentos

Por Julie Kowalski, Sharon Lupo y Jack Cochran
La cromatografía líquida acoplada a la espectrometría de masas en tándem (LC-MS/MS) se utiliza comúnmente para el control de los residuos de plaguicidas en los alimentos. La elevada selectividad y sensibilidad de la técnica LC-MS/MS ha tenido un impacto en la realización de métodos de múltiples residuos, disminuyendo la necesidad de una rigurosa preparación de muestras en ciertas ocasiones. Sin embargo, este abordaje conlleva un «efecto matriz», que provoca deficiencia en la calidad de los datos y dificulta la cuantificación. El efecto matriz puede mitigarse mediante una preparación de la muestra que reduzca la concentración del coextracto de matriz, o mediante estrategias experimentales, como la calibración de matriz pareada (matrix-matched), que compensa el efecto matriz. Estos dos aspectos de los métodos de residuos múltiples, las estrategias de preparación y calibración de muestras, fueron considerados a fin de determinar recomendaciones que lograran un equilibrio entre la calidad de los datos y la inversión de tiempo y dinero.
Realizamos estudios del efecto matriz, donde investigamos dos abordajes para reducir las interferencias de matriz: la preparación de la muestra según el método QuEChERS y dilución, combinado con la estrategia de compensación de calibración de matriz pareada y su comparación con la calibración de disolvente. Cada uno de los métodos posee sus consideraciones en términos de tiempos y costos implicados. Se evaluó una serie de alimentos, que incluyeron productos con alto contenido de agua (apio), alto contenido de pigmento (col rizada), alto contenido graso (palta), cítricos (lima) y alimentos secos (harina de arroz integral), con su posterior análisis de residuos de plaguicidas mediante la técnica LC-MS/MS. Las muestras fueron fortificadas a niveles altos y bajos de ppb con más de 100 plaguicidas que representaban múltiples clases.
Determinamos que, con los materiales más simples, el método de dilución y la calibración de solo disolvente arrojaron valores de recuperación aceptables. Sin embargo, a fin de obtener valores de recuperación aceptables con otros materiales, se empleó una curva de calibración de matriz pareada y/o un proceso de limpieza. Los materiales con alto contenido de carbohidratos y cítricos demostraron ser muy complejos de abordar con los métodos específicos que analizamos aquí. Casi en todos los casos, el uso de la calibración de matriz pareada mostró una mejoría.
Introducción
Los profesionales dedicados al análisis de trazas enfrentan muchos desafíos, entre ellos, los residuos de plaguicidas. Algunos desafíos se relacionan con los distintos materiales que deben analizarse y la gran cantidad de analitos que existen. Últimamente, la tendencia ha sido lograr mayor rapidez y simpleza en los métodos analíticos, pero al mismo tiempo, poder detectar niveles más bajos y analizar muchos analitos en un solo análisis (métodos para residuos múltiples).
La cromatografía líquida acoplada a la espectrometría de masas en tándem (LC-MS/MS) es comúnmente utilizada para este tipo de análisis, dado que resuelve algunos de estos desafíos y resulta apropiada para muchos más plaguicidas que las técnicas de cromatografía de gases. Para la identificación y la cuantificación de los plaguicidas se utilizan los tiempos de retención, las transiciones iónicas y los coeficientes de transición. Al analizar las transiciones iónicas, la espectrometría de masas en tándem aumenta la selectividad filtrando iones específicos. Esta selectividad elimina el ruido, lo que genera un gran aumento en la relación señal-ruido y, en consecuencia, incrementa la sensibilidad.
Si bien la espectrometría de masas en tándem es altamente selectiva y sensible, los compuestos de coelución pueden provocar interferencias en la interfaz LC-MS durante la ionización por electrospray (ESI, según su sigla en inglés), que ocurre previo al análisis de masa y a la generación de señal. La inconsistencia en la ionización provoca una deficiente calidad de datos e impide en gran medida obtener una cuantificación exacta. Empleamos el término «efecto matriz» para hacer referencia a este problema de ionización. El efecto matriz de un compuesto es el cambio en la ionización en disolvente comparado con la ionización en matriz. Los coextractos de la matriz pueden modificar la eficiencia de la ionización de un analito y provocar la supresión o la intensificación de la señal. Se debe tener en cuenta el efecto matriz para garantizar resultados cuantitativos aceptables de cualquier método LC-MS/MS.
Es posible compensar el efecto matriz con un diseño experimental, por ejemplo, utilizando patrones isotópicos rotulados o calibración de matriz pareada. Esta última demostró ser efectiva, pero conlleva mayores tiempos y costos en el análisis. Además, puede resultar difícil encontrar materiales que no contengan plaguicidas y sean analitos diana. Se ha intentado utilizar un conjunto de muestras con matriz pareada para diversos materiales, pero con resultados inconsistentes [1, 2,3].
Mediante procedimientos de limpieza de la muestra es posible eliminar los compuestos de matriz de forma selectiva. Esto disminuye las concentraciones de coextractos y mantiene las concentraciones de los analitos diana, pero puede resultar muy laborioso y conllevar más costos. Además, algunos analitos pueden perderse durante el procesamiento de la muestra. Las técnicas más comunes para la preparación de las muestras incluyen: extracción líquido-líquido, extracción de fase sólida y el método QuEChERS. Este último incluye pasos de extracción y de limpieza que eliminan los compuestos de matriz y mantienen los analitos en sus concentraciones iniciales. Otro abordaje consiste en reducir el efecto matriz diluyendo la muestra directamente. Esto disminuye la concentración de coextractos de la matriz, pero también reduce la concentración de analitos diana. Las diluciones más altas reducen o eliminan el efecto matriz de manera más satisfactoria, pero se requiere cada vez más sensibilidad a medida que aumentan los factores de dilución. Las diluciones varían de 10 a 100 veces [4] y seleccionar el factor de dilución correcto dependerá de las concentraciones de analitos y coextractos, además de las propiedades químicas y de la sensibilidad del instrumento. Por ejemplo, a menudo se emplean 10 ppb como concentración de referencia, dado que dicho valor representa el límite máximo común residual para muchos plaguicidas en varios alimentos. Si diluimos la muestra 50 veces, debemos detectar y cuantificar los plaguicidas a 0,2 ppb o 200 ppt (partes por billón). En ciertas ocasiones, la excelente sensibilidad de la espectrometría de masas en tándem logra resolver este desafío de sensibilidad de los métodos basados en dilución.
La técnica de dilución ha sido muy promocionada en los últimos años y, ciertas veces, ha sido avalada como método universal. Ha demostrado su éxito en muchas aplicaciones, incluido el análisis de residuos de plaguicidas. La dilución resulta atractiva porque elimina la necesidad de preparación de la muestra y sus costos asociados. Sin embargo, el análisis de residuos de plaguicidas incluye una amplia variedad de alimentos, además de un gran número de plaguicidas con diversas propiedades fisioquímicas. En general, un único método no ha resultado suficiente para abordar dicha complejidad. Por esa razón, es importante evaluar la efectividad de las técnicas de preparación de muestras y definir las recomendaciones para aplicar distintas estrategias.
Evaluamos una serie de plaguicidas comúnmente empleados en métodos de residuos múltiples. Analizamos alrededor de 100 plaguicidas de diferentes clases químicas, incluidos carbamato, organofosforados, anilinas, conazol, lactona macrocíclica, fenilurea, benzoilfenilurea y plaguicidas de estrobilurinas. Evaluamos un grupo de materiales que representan distintos tipos de alimentos, desde los más sencillos hasta los más complejos. Los alimentos con alto contenido de agua, bajo contenido graso, bajos niveles de carbohidratos y bajo contenido de pigmentos se consideran los más simples de analizar, dado que sus extractos no contienen la gran cantidad de compuestos de coextracto que se encuentran presentes en los productos secos con alto contenido de grasas, carbohidratos y pigmentos.
El desempeño del método fue evaluado en términos de los valores del efecto matriz, los valores aceptables de recuperación de plaguicida y el número de plaguicidas detectado. Fortificamos los alimentos y procesamos las muestras según el método QuEChERS y la técnica de dilución. Luego, determinamos los valores de recuperación. La cuantificación se realizó de dos maneras: se empleó una curva de calibración de disolvente y una curva de calibración de matriz pareada. Se evaluaron los métodos de calibración comparándolos con los valores de recuperación. El diseño experimental arroja cuatro conjuntos de datos con los valores de recuperación para cada material: dilución con calibración de disolvente, dilución con calibración de matriz pareada, QuEChERS con calibración de disolvente y QuEChERS con calibración de matriz pareada. Esto permite evaluar las combinaciones de los métodos de preparación y calibración de muestras.
Ensayos
Sustancias químicas y materiales
Se emplearon disolventes de grado LC-MS, que fueron adquiridos en Fisher Scientific (Pittsburgh, PA). El ácido fórmico se adquirió en Sigma-Aldrich (Milwaukee, WI) y el formato de amonio en Alfa Aesar (Ward Hil, MA). Los tubos de extracción y los tubos de extracción en fase sólida dispersiva (dSPE) para QuEChERS, así como los patrones internos y los de control de calidad para QuEChERS, se compraron a Restek Corporation (Bellefonte, PA). La mezcla de alrededor de 100 plaguicidas en acetonitrilo fue un patrón personalizado que se combinó con una mezcla adicionada de AOAC (cat.# 31999). Los patrones internos, atrazina-d5 y diazinona-d10, se compraron en Sigma-Aldrich (Milwaukee, WI). Los alimentos se adquirieron en una tienda local, e incluyeron apio, col rizada, palta, lima y harina de arroz integral. Los mismos se almacenaron a -20 °C.
Preparación de la muestra
Selección de los alimentos
El apio se considera el material más sencillo, dado que posee un alto contenido de agua, un nivel medio de pigmentos y es bajo en grasas y carbohidratos. La col rizada posee alto contenido de agua y de pigmentos, lo que produce un extracto de color intenso. La lima representa la fruta cítrica. Si bien se sabe que los cítricos son complejos para las técnicas LC-MS/MS, incluimos la lima (con cáscara) para observar las diferencias entre los métodos. La palta representa la categoría de alto contenido graso. La harina de arroz integral es un grano seco con elevado contenido de carbohidratos. La Tabla I muestra la composición nutricional de cada alimento analizado.
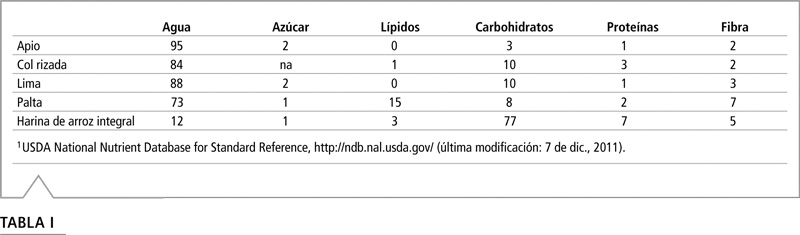
Tabla I: Contenido nutricional de cada alimento en gramos por cada 100 gramos de material comestible.1
1 USDA National Nutrient Database for Standard Reference, http://ndb.nal.usda.gov/ (última modificación: 7 de dic., 2011).
Fortificación de los alimentos
Los alimentos congelados se homogeneizaron con un procesador de alimentos, se los pesó y fortificó con plaguicidas a 10 y 500 µg/kg (ppb). Se adicionaron los patrones internos atrazina-d5, diazinona-d10 y la mezcla de AOAC (cat.# 31963) a una concentración final de extracto de 250 ppb. Se prepararon muestras no fortificadas para determinar los plaguicidas incurridos y producir patrones de matriz pareada.
Extracción QuEChERS AOAC
Se utilizó el método de extracción QuEChERS AOAC para analizar el apio, la col rizada y la lima. Para estas muestras, se agregaron 15 ml de acetonitrilo con ácido acético al 1% (v/v) a 15 g de muestra fortificada homogeneizada [5]. Se agregaron sales de extracción AOAC Q-sep® (cat.# 26237) con 6 g de MgSO4, 1,5 g de acetato de sodio. En esta instancia, se ajustó el pH de las muestras de lima añadiendo 900 µL de una solución de hidróxido de sodio 5N (o M, mol/L*) al tubo de extracción. Este ajuste del pH se basó en la recomendación del método EN, pero se lo escaló para una muestra de 15 g [6]. Tras agitar las muestras manualmente por 1 minuto, se las centrifugó durante 5 minutos a 3.000 xg con una centrífuga Q-sep® 3000 (cat.# 26230). La capa superior de acetonitrilo se transfirió a un vial limpio.
Para las muestras de dilución, se diluyó el extracto 20 veces en la fase inicial móvil, a una relación 90:10 (v:v) de agua con 4 mM de formato de amonio y ácido fórmico al 0,1% a metanol con 4 mM de formato de amonio y ácido fórmico al 0,1%.
*Una solución de hidróxido sódico 5 N equivale a una solución de 5 M (molar, mol/L).
Extracción QuEChERS sin buffer
Se utilizó el método de extracción original sin buffer para la palta y la harina de arroz integral, con ajustes para humectar la muestra [7]. Para la harina de arroz integral, se combinaron 5 g de harina de arroz integral, 15 ml de agua desionizada, y 10 ml de acetonitrilo en un tubo de centrífuga de 50 ml. Luego, la muestra se mezcló en vórtice brevemente y se la agitó durante una hora en mesa vibratoria. Para la palta, se añadieron 3 ml de agua, 10 g de palta homogeneizada parcialmente descongelada y 10 ml de acetonitrilo en un tubo de centrífuga de 50 ml; se los mezcló durante un minuto. Se centrifugaron las muestras durante 5 minutos a 3.000 xg con una centrífuga Q-sep® 3000 (cat.# 26230). La capa superior de acetonitrilo se transfirió a un vial limpio.
Para el análisis de dilución mediante LC-MS/MS, se diluyó el extracto 20 veces con una fase inicial móvil, a una relación 90:10 (v:v) de agua con 4 mM de formato de amonio y ácido fórmico al 0,1% a metanol con 4 mM de formato de amonio y ácido fórmico al 0,1%.
Limpieza QuEChERS con extracción en fase sólida dispersiva (dSPE)
Se emplearon tubos Q-sep® dSPE de Restek y se optó por formulaciones de sorbentes de acuerdo con la composición nutricional de los alimentos y los experimentos preliminares que analizaron la eliminación de pigmentos. La Tabla II muestra la formulación de dSPE, la cantidad de extracto procesado, el tiempo de agitación manual, el método específico de formulación dSPE y el número de catálogo. Los tubos de limpieza contenían uno o más de tres sorbentes: amina primaria/secundaria (PSA), octadecilo (C18) y carbón negro grafitizado (GCB). Además de los contenidos enumerados en la Tabla II, cada tubo de dSPE contenía 150 mg de sulfato de magnesio por ml de extracto procesado. Después de añadir extracto de acetonitrilo al tubo dSPE, el mismo se agitó durante el período especificado en la Tabla II. Luego, se centrifugaron las muestras durante 5 minutos a 3.000 xg. Para el análisis LC-MS/MS, se diluyó el extracto 10 veces con una fase inicial móvil, a una relación 90:10 (v:v) de agua con 4 mM de formato de amonio y ácido fórmico al 0,1% a metanol con 4 mM de formato de amonio y ácido fórmico al 0,1%.
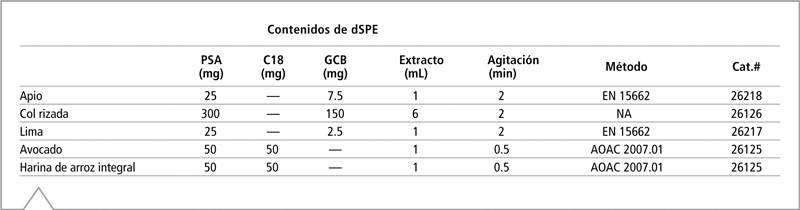
Tabla II: A continuación, se describe la fórmula de sorbente dSPE y el volumen de extracto utilizados durante la limpieza de la muestra para cada alimento. También se especifica el tiempo de agitación requerido, el método asociado con cada formulación y el número de catálogo Restek.
Patrones de calibración con disolventes y matriz pareada
Existen dos estrategias de calibración frecuentemente utilizadas para el análisis LC-MS/MS de residuos de plaguicidas: la curva de calibración con disolvente y la curva de calibración de matriz pareada. La curva de disolventes emplea analitos en un disolvente común. La curva de calibración con disolvente que se generó contenía plaguicidas en distintos niveles en la fase inicial móvil en una relación de 90% de agua con 4mM de formato de amonio y ácido fórmico al 0,1% y 10% de metanol con 4 mM de formato de amonio y ácido fórmico al 0,1% (v/v). Se generaron a diario curvas de disolvente para el método de dilución, con niveles de calibración de 0,25, 0,5, 1, 2, 10, 25 y 50 ppb con compuestos de patrones internos a 12,5 ppb.
Debido a que inicialmente solo se procesaron 5 g de harina de arroz integral, la concentración de inyección esperada de las muestras adicionadas a 10 ppb fue de 0,25 ppb. Por lo tanto, se añadió un nivel de calibración de 0,1 ppb para las muestras de harina de arroz integral. También se prepararon a diario curvas de calibración de disolvente para el método QuEChERS, con concentraciones de 0,5, 1, 2, 10, 25, 50 y 75 ppb con compuestos de patrones internos a 25 ppb. Los patrones de disolventes se prepararon en una relación de 90% de agua con 4mM de formato de amonio y ácido fórmico al 0,1% y 10% de metanol con 4 mM de formato de amonio y ácido fórmico al 0,1% (v/v).
Las curvas de calibración de matriz pareada para el método de dilución se generaron combinando 50 µL de solución de matriz (pre-limpieza) con la solución madre de patrones de plaguicida y agua con 4 mM de formato de amonio y ácido fórmico al 0,1%, llegando a un total de 1 ml, lo que resultó en una dilución de la matriz de 20 veces. Esto se hizo para los patrones de calibración a 0,25, 0,5, 1, 2, 10, 25 y 50 ppb con compuestos de patrones internos a 12,5 ppb. Nuevamente, se añadió un patrón de calibración de 0,1 ppb para las muestras de harina de arroz integral. Las curvas de matriz pareada para el método QuEChERS se produjeron combinando 100 µL de solución de matriz (post-limpieza) con la solución madre de patrones de plaguicida y agua con 4 mM de formato de amonio y ácido fórmico al 0,1%, llegando a un total de 1 ml, lo que resultó en una dilución de la matriz de 10 veces. Los patrones de calibración incluyeron plaguicidas a 0,5, 1, 2, 10, 25, 50 y 75 ppb con compuestos de patrones internos a 25 ppb.
Análisis LC-MS/MS
Para realizar el análisis LC-MS/MS de residuos de plaguicidas se utilizó un equipo Shimadzu UFLCXR LC (Columbia, MD) y un sistema de LC-MS/MS API 4000™ MDS SCIEX AB SCIEX de Applied Biosystems con fuente Turbo V™ (Foster City, CA). El análisis se hizo utilizando una columna de 100 mm x 2,1 mm, Ultra Aqueous C18 de 3 µm (Restek, cat.# 9178312) e inyecciones de 20 µL. Se mantuvo la columna a 50 °C. Se utilizó un gradiente de fase móvil del disolvente A, agua con 4 mM de formato de amonio y ácido fórmico al 0,1%, y del disolvente B, metanol con 4 mM de formato de amonio y ácido fórmico al 0,1% y una velocidad de flujo de 0,5 ml/min. La Tabla III muestra el gradiente de fase móvil e incluye un paso de re-equilibración de 3 minutos. Los compuestos se ionizaron mediante ionización por electrospray positivo. Los parámetros de interfaz son los siguientes: temperatura de interfaz a 450 °C, voltaje de spray de iones de 5,5 kV, gas nebulizante a 30 psi (206,8 kPa), gas de fuente iónica 1 a 40 psi (275,8 kPa), y gas de fuente iónica 2 a 45 psi (310,3 kPa). Se optimizaron dos transiciones para cada compuesto y se las monitoreó en modo Scheduled MRM™ (sMRM). La ventana de MRM fue de 45 segundos y el tiempo de escaneo objetivo fue de 0,33 segundos.
Las transiciones optimizadas MRM y los tiempos de retención de cada analito figuran en la Tabla IV, y la Tabla V muestra los voltajes optimizados. La identificación de plaguicidas se basó en la comparación del tiempo de retención y el coeficiente de transición MRM.
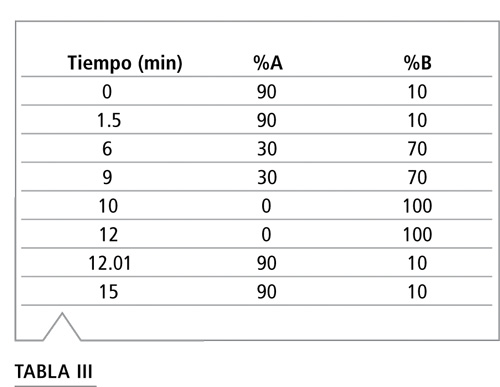
Tabla III: Programa de gradiente de fase móvil para LC-MS/MS.
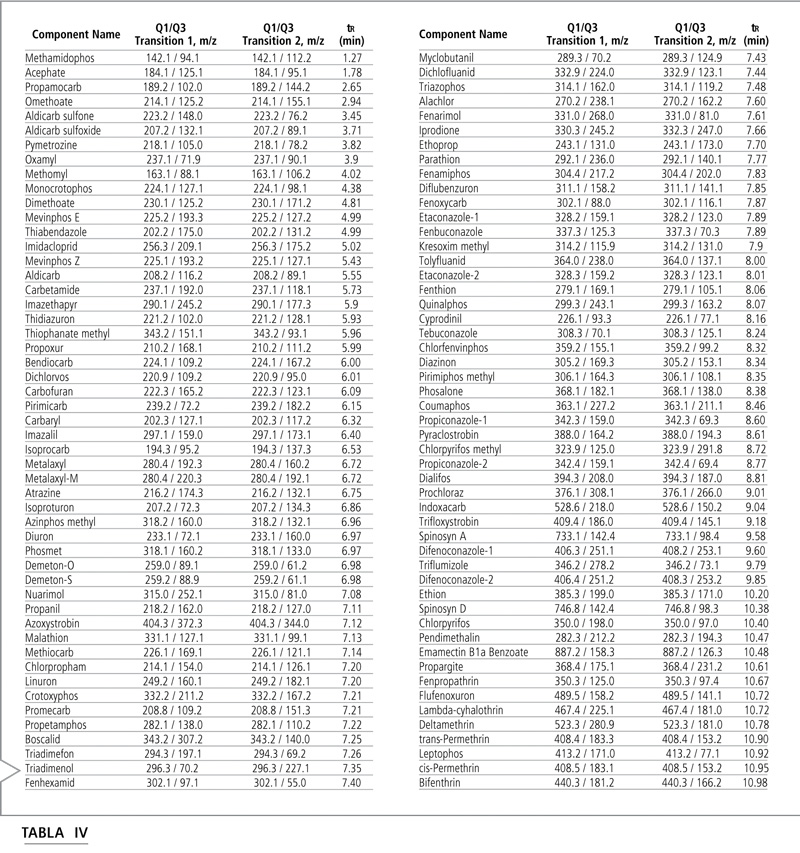
Tabla IV: Transiciones MRM y tiempos de retención de LC-MS/MS para cada analito.
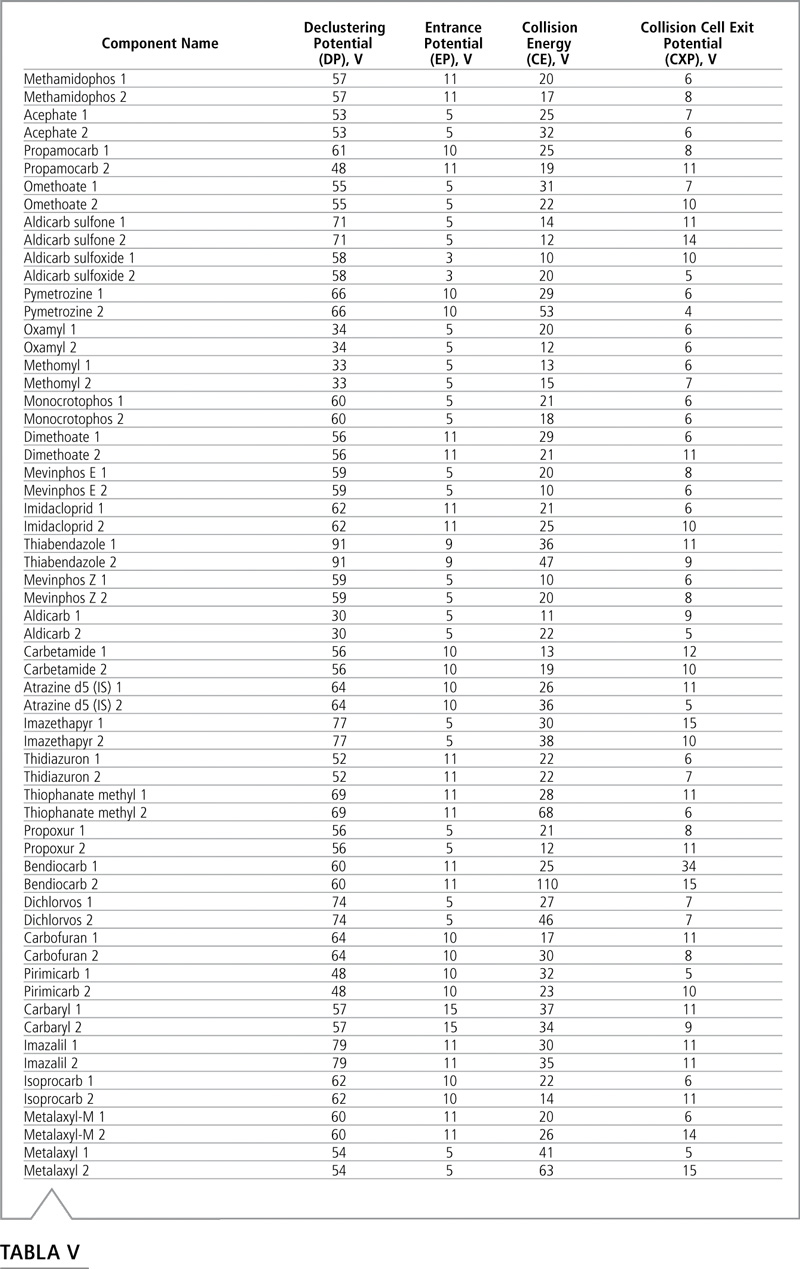
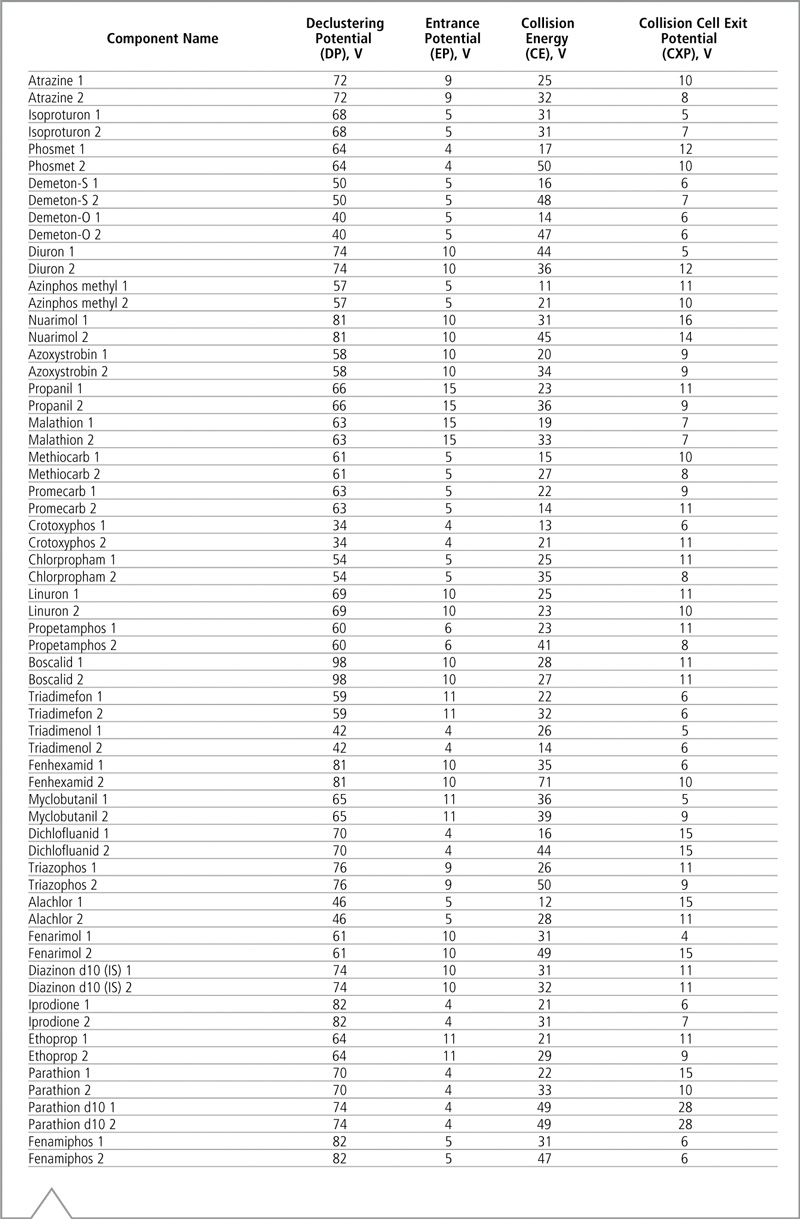
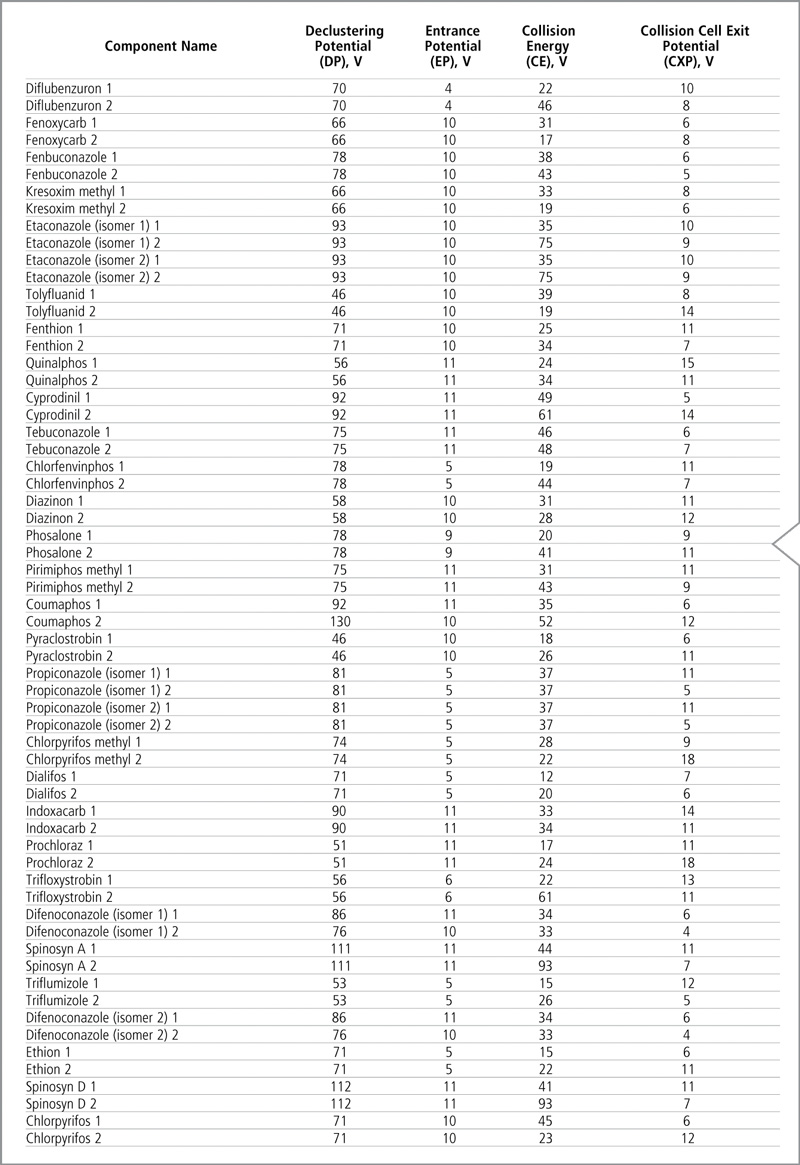
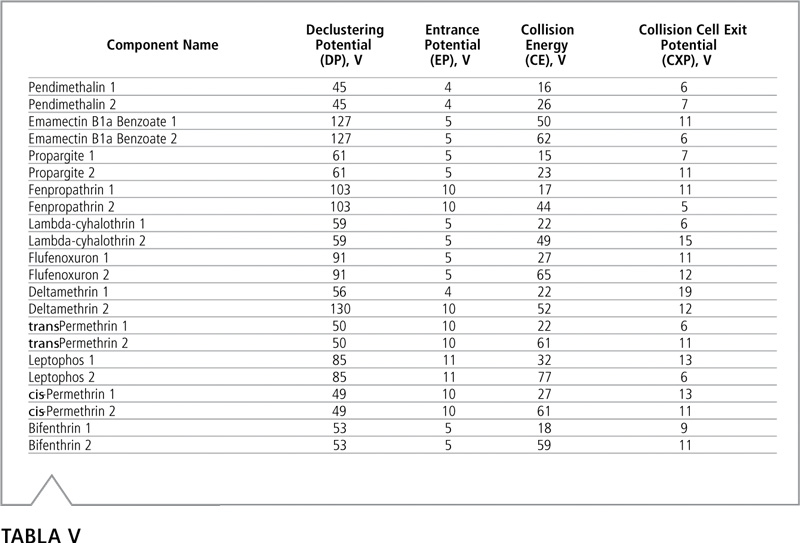

Tabla V: Voltajes optimizados para el modo MRM de LC-MS/MS. Los voltajes para la primera y segunda transición están designados con los números 1 y 2, respectivamente.
Determinación del efecto matriz
Se determinaron los valores del efecto matriz para cada plaguicida en cada alimento. Los datos se obtuvieron a partir de la curva de calibración de disolvente y la curva de matriz pareada antes mencionadas. Los valores del efecto matriz se calcularon comparando la relación de la pendiente de la curva de disolvente con la pendiente de la curva de matriz pareada. La Ecuación 1 muestra el cálculo utilizado para determinar el efecto matriz. Los valores superiores a 100% indican una ionización intensificada en la matriz y los valores inferiores a 100% confirman la supresión de la señal iónica debido a la matriz.
Ecuación 1: %EM = (pendiente curva matriz pareada) *100
pendiente curva disolvente
Determinación del porcentaje de recuperación de plaguicida
Se prepararon muestras fortificadas en dos niveles, 10 y 500 µg/kg (ppb) para el método QuEChERS y para el método de dilución. Se empleó atrazina-d5 como patrón interno. La cuantificación se realizó de dos formas, utilizando una curva de calibración de disolvente y una curva de calibración de matriz pareada. Se comparó la concentración calculada con la concentración esperada, suponiendo una recuperación del 100%. Para cada plaguicida existe un conjunto de cuatro valores de recuperación por nivel de fortificación: dos valores de recuperación para el método QuEChERS y dos valores para el método de dilución. Estos valores se basan en la cuantificación de plaguicida mediante el uso de una curva de disolvente y una curva de matriz pareada. La Tabla VI muestra las abreviaturas de las cuatro categorías del porcentaje de recuperación.
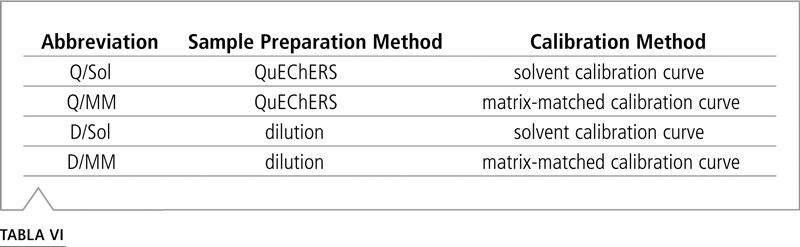
Tabla VI: Abreviaturas para las combinaciones de preparación de la muestra y método de calibración.
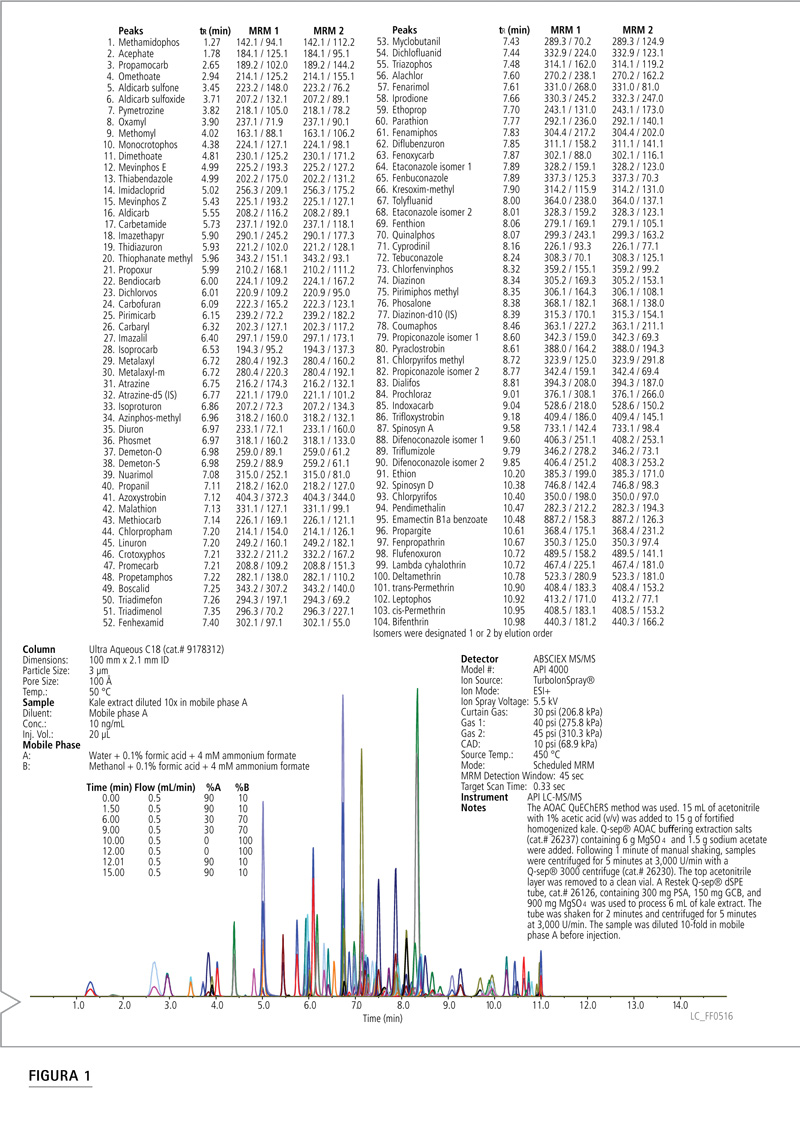
Figura 1: Cromatograma de extracto de col rizada fortificada con plaguicidas con método QuEChERS.
Resultados y consideraciones
Análisis LC-MS/MS
La Figura 1 ilustra un cromatograma de extracto de col rizada procesado con el método QuEChERS. Esto es representativo de los cromatogramas que se generaron en este trabajo. Los analitos se eluyeron en 11 minutos, seguidos de un breve enjuague con alto contenido de orgánicos y un paso de estabilización. Este enjuague con alto contenido de compuestos orgánicos fue importante para mantener la columna y evitar la transferencia de matriz a la siguiente muestra. La elución del material de matriz remanente puede provocar efectos matriz inesperados durante un análisis posterior. Existe evidencia de que los compuestos de matriz con elución tardía en un análisis HPLC de fase inversa pueden provocar una supresión iónica significativa [2].
El tiempo de retención fue fundamental para identificar los plaguicidas y se lo utilizó para generar el programa Scheduled MRM. Es por eso que la reproducibilidad del tiempo de retención es de suma importancia. Analizamos aproximadamente 380 muestras, cada una mostró 204 transiciones MRM, lo que resultó en 77.520 transiciones MRM. Solo cuatro transiciones, o 0,005%, presentaron cambios; todas ellas fueron isómeros que pudieron integrarse manualmente e informarse como un pico. Por lo general, resulta difícil analizar plaguicidas polares de elución temprana en columnas C18 y, a menudo presentan retención baja o nula y una forma de pico deficiente. Sin embargo, obtuvimos excelentes resultados al utilizar una columna Ultra Aqueous C18. Analizamos plaguicidas polares como metamidofos, acefato, propamocarb y ometoato mediante una columna Ultra Aqueous C18 (100 mm x 2,1 mm, 3µm). Esta columna polar modificada de fase estacionaria C18 puede interactuar con compuestos polares y no polares. Esto generó una retención significativa y buenas formas de pico para los plaguicidas polares de elución temprana. Además, los analitos remanentes se distribuyeron a lo largo de la ventana de elución. Esto contribuye a garantizar una adecuada tasa de escaneo para los métodos Scheduled MRM con muchos analitos.
Interpretación del efecto matriz
El efecto matriz para cada compuesto se calculó de acuerdo con la Ecuación 1 mencionada anteriormente. Si suponemos que las pendientes de la curva de calibración de disolventes y de la curva de matriz pareada son iguales, entonces no habrá efecto matriz y el coeficiente de pendiente será 1, lo que significa que la señal de un compuesto en la matriz y en el disolvente es exactamente la misma. Un valor de efecto matriz superior a 100% indica un aumento de señal cuando se analiza el analito en la matriz. Cuando el valor es inferior a 100%, significa que la señal del analito en la matriz es menor o se encuentra suprimida, en comparación con el analito en el disolvente.
Ilustramos el efecto matriz completo trazando el efecto matriz calculado menos 100 para cada compuesto en orden ascendente del tiempo de retención. Estos gráficos identifican las tendencias del efecto matriz, como la supresión o la intensificación general en un alimento específico, o la relación entre tiempo de retención y efecto matriz. Los gráficos del efecto matriz se generaron para muestras procesadas con el método QuEChERS y el método de dilución, y se los puede emplear para comparar tendencias. Por ejemplo, los gráficos para apio de la Figura 2 muestran que el método de dilución produjo un aumento de la señal, mientras que el apio procesado con el método QuEChERS mostró la supresión de misma. Sin embargo, ambos métodos producen muestras con un aumento de la señal hacia el final del cromatograma.
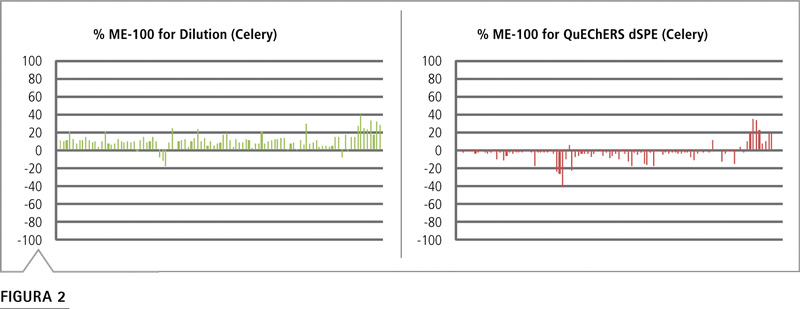
Figura 2: Efecto matriz para apio según el orden del tiempo de retención El método de dilución tendía a producir un aumento en la señal, mientras que el método QuEChERS generaba la supresión de la misma.
Los efectos matriz más pronunciados en puntos específicos del cromatograma pueden ser indicativos del tipo de compuesto de coextracto presente en la muestra. Por ejemplo, un marcado efecto matriz al final de un análisis cromatográfico de fase reversa indica que los compuestos hidrofóbicos, como los lípidos, podrían causar problemas de ionización. Si observamos el gráfico para palta, con alto contenido graso, en la Figura 3, se observa una supresión iónica al final de la ventana de elución para las muestras producidas por ambos tratamientos. Es lógico concluir que el contenido de lípido permanece en ambas muestras.
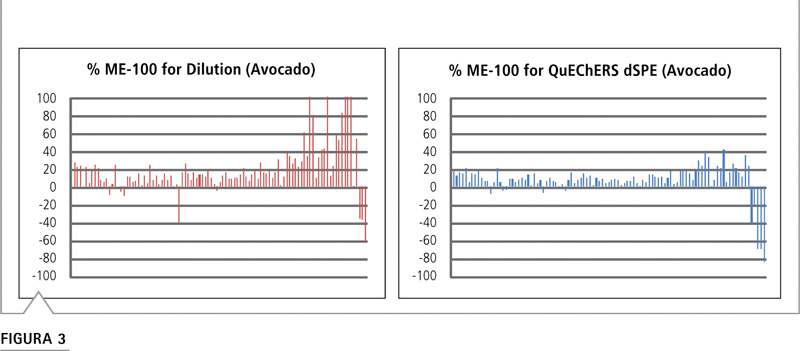
Figura 3: Efecto matriz para palta de acuerdo con el orden del tiempo de retención. Se evidencia la supresión de la señal para los compuestos de elución tardía tanto para las muestras procesadas por dilución como para las procesadas por QuEChERS.
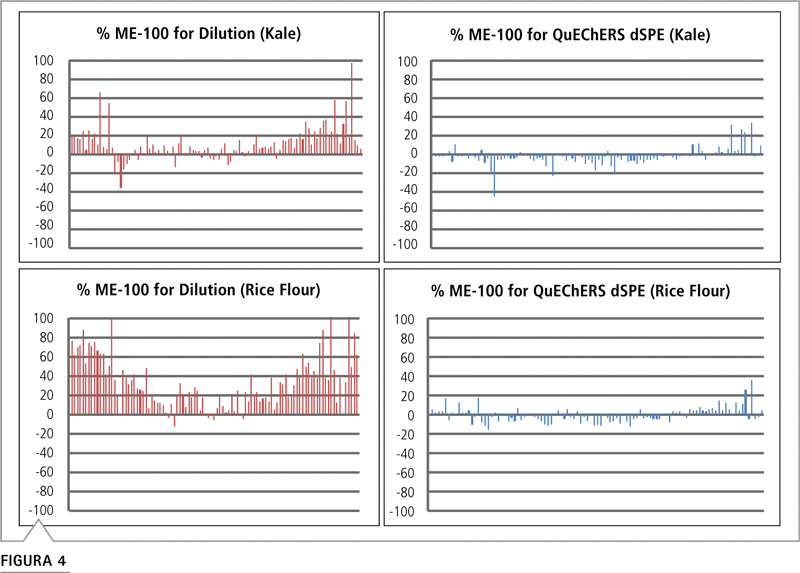
Figura 4: Gráficos del efecto matriz para col rizada (arriba) y harina de arroz integral (abajo). El método QuEChERS reduce el efecto matriz en muchos plaguicidas.
Los gráficos correspondientes a col rizada y harina de arroz muestran que el método QuEChERS puede mitigar el efecto matriz en algunas partes del cromatograma. La intensidad de la señal al inicio y al final de los cromatogramas de col rizada disminuye al tratar la muestra con el método QuEChERS (Figura 4). Los gráficos de harina de arroz integral, también ilustrados en la Figura 4, muestran un claro ejemplo de la reducción del efecto matriz con la muestra QuEChERS para muchos plaguicidas, en especial, para aquellos de elución temprana y tardía, como los que aparecen en el gráfico en forma de U del método de dilución. Los gráficos de lima no mostraron ninguna tendencia clara.
Evaluación del efecto matriz
Los valores del efecto matriz del 80 al 120% se consideran aceptables e indican un efecto matriz leve. Es un rango aceptable para quienes analizan los residuos de plaguicidas. Por lo general, este rango 100±20% se emplea como valor de corte para justificar el uso de la calibración por disolvente en lugar de los patrones de matriz pareada. Evaluamos las diferentes estrategias de análisis, comparando el porcentaje de compuestos analizados que entraban dentro de ± 20% de los valores de curva de disolvente (Figura 5). El número total de compuestos es 102, pero aquí se lo ajusta para los plaguicidas incurridos. Se eliminaron de ambos conjuntos de datos los plaguicidas incurridos y determinados por el método QuEChERS o método de dilución. El número osciló de tres plaguicidas incurridos para harina de arroz integral a quince plaguicidas incurridos para apio.
La Figura 5 describe los materiales en orden de menor a mayor dificultad y de izquierda a derecha.
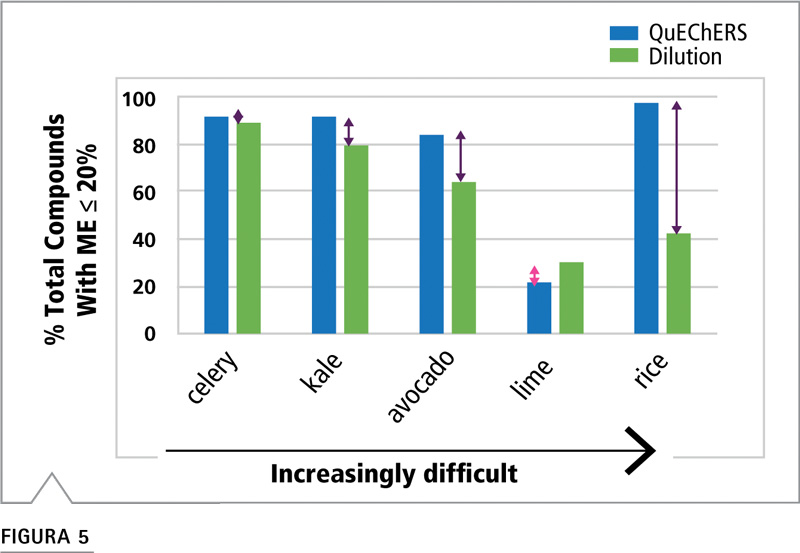
Figura 5: Comparación del porcentaje de analitos que poseen efecto matriz dentro del 80 al 120%, por material y método de preparación de muestra.
El apio posee alto contenido de agua, color intermedio y bajo contenido de grasa. Los rendimientos de los métodos QuEChERS y dilución son casi idénticos, con efecto matriz del 92% y 90%, respectivamente. Ambas estrategias para disminuir la concentración del material coextraído resultaron exitosas. En el caso del apio, el método de dilución ahorró tiempo y eliminó la pérdida potencial de analitos durante la limpieza de la muestra.
Como se ilustra en la Figura 6, el proceso inicial de extracción QuEChERS fue empleado tanto para el método QuEChERS como para el de dilución. La capa superior oscura es el extracto de acetonitrilo que se preparó de dos formas para realizar el análisis. Para la muestra de dilución, este extracto se diluyó 20 veces y luego se analizó, mientras que para el método QuEChERS, se continuó procesando el extracto mediante una extracción en fase sólida dispersiva, y luego se lo diluyó 10 veces y se analizó. La mayor parte del pigmento fue eliminada por GCB durante la limpieza dSPE; sin embargo, incluso con este nivel de dilución, aún se observa una significativa cantidad de pigmento. Esto afecta el grado de limpieza de la interfaz LC-MS/MS, dado que se necesita de una mayor frecuencia de limpieza a fin de mantener el mismo nivel de calidad de datos. De acuerdo con la Figura 5, los métodos QuEChERS y de dilución mostraron un rendimiento bastante aceptable y similar para col rizada, comparado con el efecto matriz del analito. El método QuEChERS arrojó un menor efecto matriz en el 91% de los analitos, comparado con el método de dilución que alcanzó un bajo efecto matriz para el 80% de los analitos. Es una diferencia relativamente pequeña de alrededor de diez compuestos. El método QuEChERS ofrece una leve ventaja para minimizar el efecto matriz que, en general, puede contribuir a extender los intervalos de limpieza de interfaz. El método de dilución posee un buen rendimiento y requiere menor tiempo de preparación de muestras y menores costos. Se calcula que con el método QuEChERS se prolonga una hora y media más el tiempo total de procesamiento.

Figura 6: Preparación de muestras de col rizada para análisis. De izquierda a derecha, capas de muestra separadas en tubo de extracción, extracto (capa de disolvente) transferido a vial limpio, extracto tratado con limpieza dSPE, extracto pos-limpieza diluido 10 veces (muestra QuEChERS para análisis), y extracto pre-limpieza diluido 20 veces (muestra de dilución para analizar).
La palta presenta un mayor desafío, principalmente debido a su alto contenido de grasa y bajo contenido de agua. La limpieza QuEChERS empleó 50 mg de sorbente C18 por cada mililitro de extracto para eliminar los compuestos grasos coextraídos. La Figura 5 muestra que tanto el método QuEChERS como el de dilución fueron menos efectivos en minimizar el efecto matriz de la palta, en comparación con alimentos más simples como el apio y la col rizada. El método QuEChERS arrojó un bajo efecto matriz para el 84% de los analitos, que aún puede considerarse un rendimiento aceptable. Por el contrario, el método de dilución produjo bajo efecto matriz para solo el 64% de los analitos, lo que significa que no logró mitigar el efecto matriz tan bien como el método QuEChERS para esta matriz. Esta diferencia de rendimiento equivale a alrededor de 20 analitos o a un quinto de todos los analitos diana. La Figura 3 muestra que la eliminación del material lipídico de la matriz mediante la limpieza dSPE mejoró el efecto matriz de los analitos en la última parte del análisis, en donde se espera una coelución con los compuestos de tipo lipídico.
El deficiente rendimiento de ambos métodos para la lima no es de sorprender, dado que se conoce la dificultad de analizar cítricos con los métodos LC-MS/MS [2,3,4,8]. A pesar de los inconvenientes, el análisis de los residuos de plaguicidas para el material cítrico aún se realiza mediante LC-MS/MS, razón por la cual incluimos la lima en este trabajo. El método QuEChERS produjo bajo efecto matriz solo para el 22% de los analitos, mientras que el método de dilución lo hizo para el 30% de los analitos, lo que equivale a una diferencia de alrededor de ocho compuestos. Se estima que los compuestos específicos de la cáscara de las frutas cítricas interfieren con el proceso de ionización [7,8].
Los granos también presentan un desafío para la preparación de la muestra debido a su sequedad y alto contenido de material de coextracción. Es por esto que se empleó un método QuEChERS modificado, como se describió anteriormente. La gran cantidad de coextractos puede intensificar el efecto matriz, dificultando así el análisis de residuos de plaguicidas por LC-MS/MS. En el caso de la harina de arroz integral, el rendimiento de los métodos es significativamente diferente (Figura 5). El método QuEChERS modificado muestra bajo efecto matriz para el 98% de los analitos, mientras que el método de dilución lo hace solo para el 42%. Esto equivale a alrededor de 55 analitos para los cuales el método QuEChERS produce efectos matriz aceptablemente bajos, pero que quedan fuera del rango del método de dilución. Esto indica que el factor de dilución de 20 no logró reducir la concentración de coextractos al grado necesario como para producir un efecto matriz útil. El paso de limpieza QuEChERS logró eliminar los carbohidratos y los ácidos grasos comúnmente presentes y en gran cantidad en los granos. Esto fue posible gracias al uso del sorbente PSA y marca una gran diferencia con respecto al efecto matriz.
Tanto el método QuEChERS como el método de dilución mostraron rendimientos adecuados en materiales con alto contenido de agua. Con este tipo de muestras, el abordaje de dilución ahorra tiempo tanto en el procesamiento de la muestra como en la preparación del patrón, dado que es posible utilizar patrones de disolventes para la calibración. A medida que el material se vuelve más complejo con mayor concentración de coextractos, especialmente grasas y carbohidratos, QuEChERS muestra un mejor desempeño para extraer más material coextraído en comparación con el método de dilución empleado en este trabajo. Esto lo demuestran las marcadas diferencias observadas para palta y harina de arroz integral. Para mitigar el efecto matriz, QuEChERS ofrece una buena alternativa para pruebas de residuos de plaguicidas, dado que funciona bien para muchos alimentos y plaguicidas y el tiempo y el costo son menores comparado con otras técnicas de limpieza de muestras.
Evaluación de las combinaciones de métodos de preparación y calibración de muestras
Evaluamos el rendimiento de las dos estrategias de procesamiento de muestras combinadas con dos métodos de calibración distintos para determinar las mejores combinaciones para los distintos tipos de materiales. A partir de lo señalado anteriormente, sabemos que el método de dilución permite ahorrar tiempo durante el procesamiento de la muestra. Sin embargo, si el método de dilución requiere una calibración de matriz pareada, se suma un tiempo considerable al ensayo completo. En algunos casos, puede ser beneficioso procesar las muestras con un método de preparación de muestras que requiera más tiempo, que permita el uso de calibración con disolvente. Cuando sea posible, el análisis de muestras mediante dilución con calibración por disolvente resulta más rápido y menos costoso. Sin embargo, a veces es posible alcanzar resultados aceptables mediante la limpieza de la muestra y la calibración de matriz pareada, lo que requiere muchos más recursos. Nuestra evaluación de la preparación de muestras combinada con distintos métodos de calibración contribuirá a establecer recomendaciones para elegir qué estrategias aplicar.
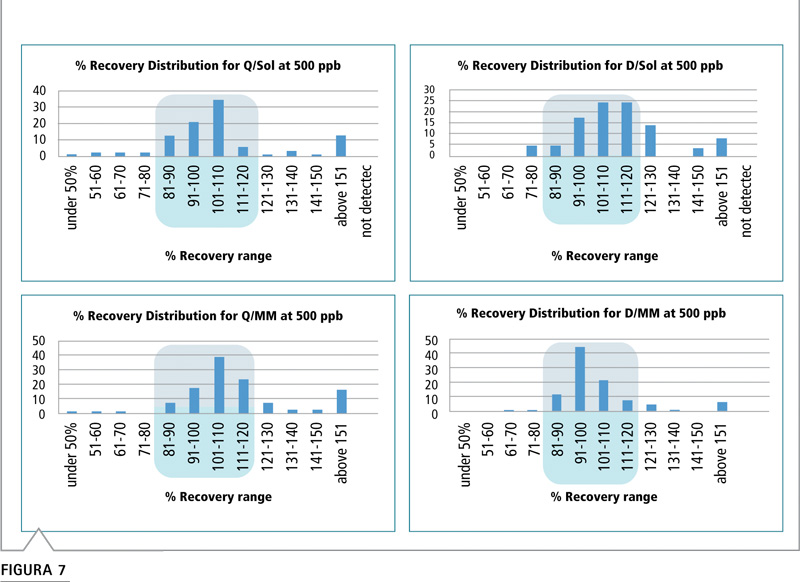
Figura 7: Distribución del porcentaje de recuperación que compara las combinaciones de preparación de muestra y estrategia de calibración para muestras de apio. (Véase Tabla VI para consultar abreviaturas).
Se calculó el porcentaje de recuperación de todos los analitos, sin incluir plaguicidas incurridos, para cada material y método de preparación de muestras, utilizando calibraciones de disolvente y de matriz pareada. Esto arroja valores de recuperación por cada plaguicida para las cuatro combinaciones de preparación/calibración de muestras. El análisis se realizó en dos niveles de fortificación, 500 ppb y 10 ppb. El nivel de 500 ppb se seleccionó dado que, de acuerdo con la experiencia, todos o la mayoría de los plaguicidas en este nivel pueden cuantificarse incluso después de 10x o 20x diluciones. Las muestras fortificadas también se prepararon a 10 ppb, dado que ese es el límite residual máximo predeterminado (MRL) para plaguicidas en alimentos si no se establece un valor determinado.
Clasificamos los plaguicidas en rangos de valor porcentual y elaboramos los gráficos de la Figura 7. El gráfico muestra el porcentaje de compuestos totales que se encontraban en el rango de recuperación señalado en el eje x para apio. El rango de recuperación de 80-120% se considera satisfactorio para el trabajo cuantitativo. Estos gráficos pueden utilizarse para comparar el sesgo de los valores de recuperación entre las estrategias de preparación y calibración de muestras. Cuando se compararon los gráficos para cada material, en general se observó la misma tendencia en el sesgo hacia valores de recuperación altos o bajos en las cuatro estrategias. Se presentaron algunas excepciones donde se eliminó el sesgo debido al uso de la calibración de matriz pareada, y no debido a una distinta preparación de la muestra (por ej., la lima mediante QuEChERS a 500 ppb y la palta con método de dilución a 10 ppb [no se muestran los datos]). El sesgo se eliminó únicamente al emplear la calibración de matriz pareada.
Calculamos el porcentaje de los compuestos que se encontraron en el rango de recuperación aceptable (80 a 120%) y lo utilizamos para comparar las combinaciones de los métodos de preparación y calibración de muestras. Esto se realizó por cada material en los niveles de fortificación de 500 y 10 ppb (Figuras 8-12). Los gráficos facilitan la comparación visual y los valores porcentuales se enumeran en la parte superior de cada barra. Durante el análisis, la respuesta de señal para algunos analitos estuvo por debajo del nivel de cuantificación o no se detectó. En este caso, el número de compuestos que no se pudieron detectar o cuantificar aparecen por encima de la barra. Este parámetro es importante para evaluar las distintas estrategias de prueba. Por ejemplo, en la Figura 8, todos los analitos pudieron cuantificarse a 500 ppb como se anticipó. A 10 ppb, el método QuEChERS, ya sea con calibración de disolvente o matriz pareada, permitió la cuantificación de todos los analitos. Sin embargo, en el método de dilución, no fue posible cuantificar ocho analitos mediante calibración de disolvente y nueve compuestos mediante patrones de matriz pareada.
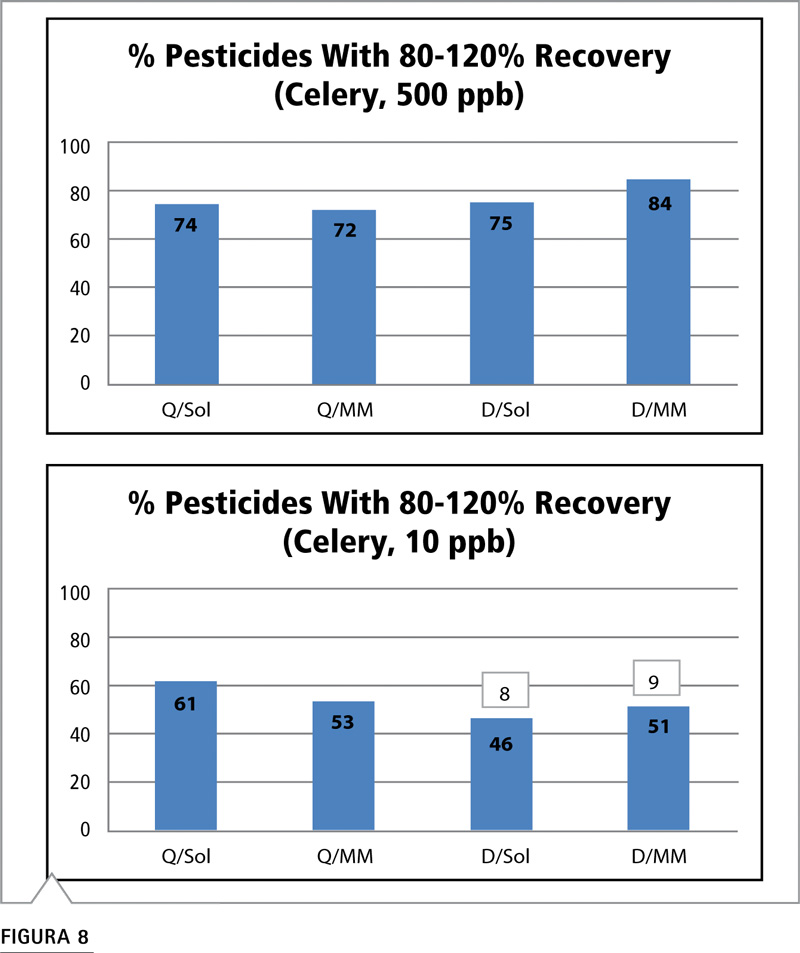
Figura 8: Comparación del porcentaje de plaguicidas con recuperaciones aceptables (80-120%) mediante estrategia de preparación/calibración de muestras a niveles de fortificación de 500 y 10 ppb en apio. (Véase Tabla VI para consultar abreviaturas).
De los materiales examinados, el apio es el más sencillo de analizar dado que se compone principalmente de agua. Si bien el extracto contenía pigmentación, la intensidad de color se redujo significativamente mediante los métodos de dilución y QuEChERS. Los datos de 500 ppb muestran que tanto la técnica QuEChERS como la de dilución funcionan bien, pero la calibración de matriz pareada presenta algunas ventajas con el método de dilución. Esto equivale a alrededor de 10 compuestos.
A 10 ppb, los resultados de las cuatro estrategias son similares. Sin embargo, el método de dilución no fue capaz de detectar todos los plaguicidas independientemente de la estrategia de calibración. La concentración de inyección fue de 0,5 ppb, que se acerca al límite de detección de algunos plaguicidas evaluados. Dado que no existe ventaja alguna en relación con los valores de recuperación al utilizar el método de dilución, elegir el método QuEChERS o al menos disminuir el factor de dilución son las mejores opciones por razones de detectabilidad.
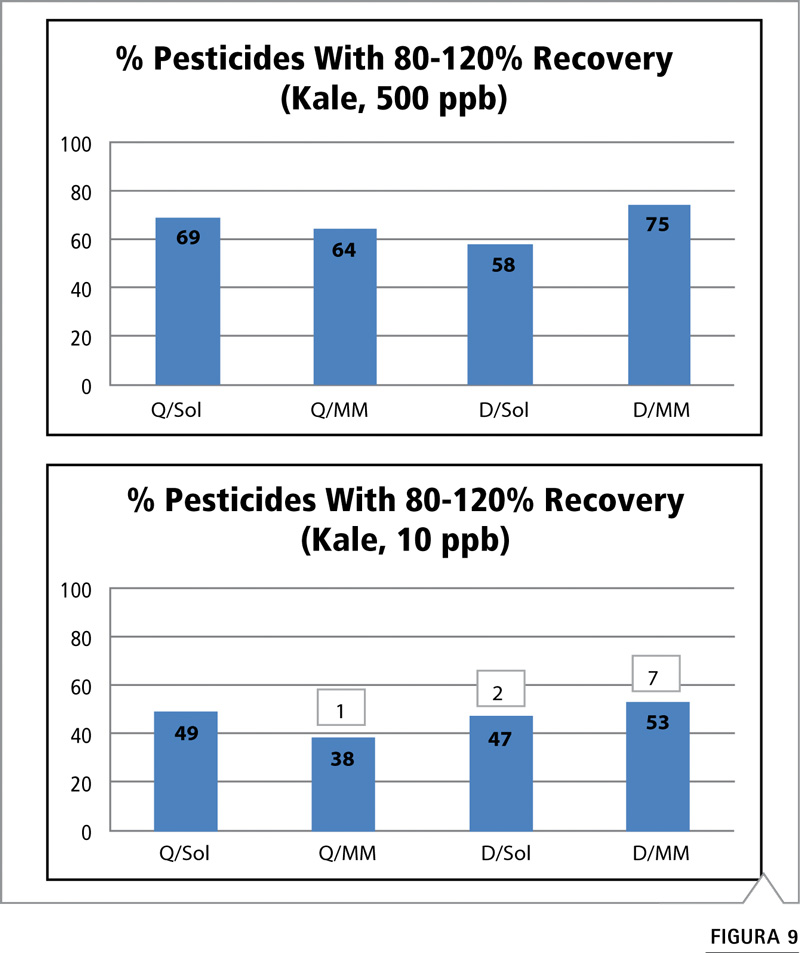
Figura 9: Comparación del porcentaje de plaguicidas con recuperaciones aceptables (80-120%) mediante estrategia de preparación/calibración de muestras a niveles de fortificación de 500 y 10 ppb en col rizada. (Véase Tabla VI para consultar abreviaturas).
La col rizada se considera levemente más compleja debido a su mayor contenido de pigmento, pero es un material relativamente sencillo dado que posee alto contenido de agua. Como se muestra en la Figura 9, a 500 ppb el rendimiento es similar entre las cuatro estrategias de preparación/calibración de muestras. Observamos nuevamente un pequeño aumento con el método de dilución al utilizar una curva de calibración de matriz pareada. Para 10 ppb, los métodos mostraron rendimientos similares a excepción del esquema de calibración QuEChERS y matriz pareada. Esto resulta sorprendente dado que la tendencia muestra una mejoría con la calibración de matriz pareada. El método de dilución presenta un buen rendimiento al igual que el método QuEChERS, pero a baja concentración no es posible detectar algunos plaguicidas.
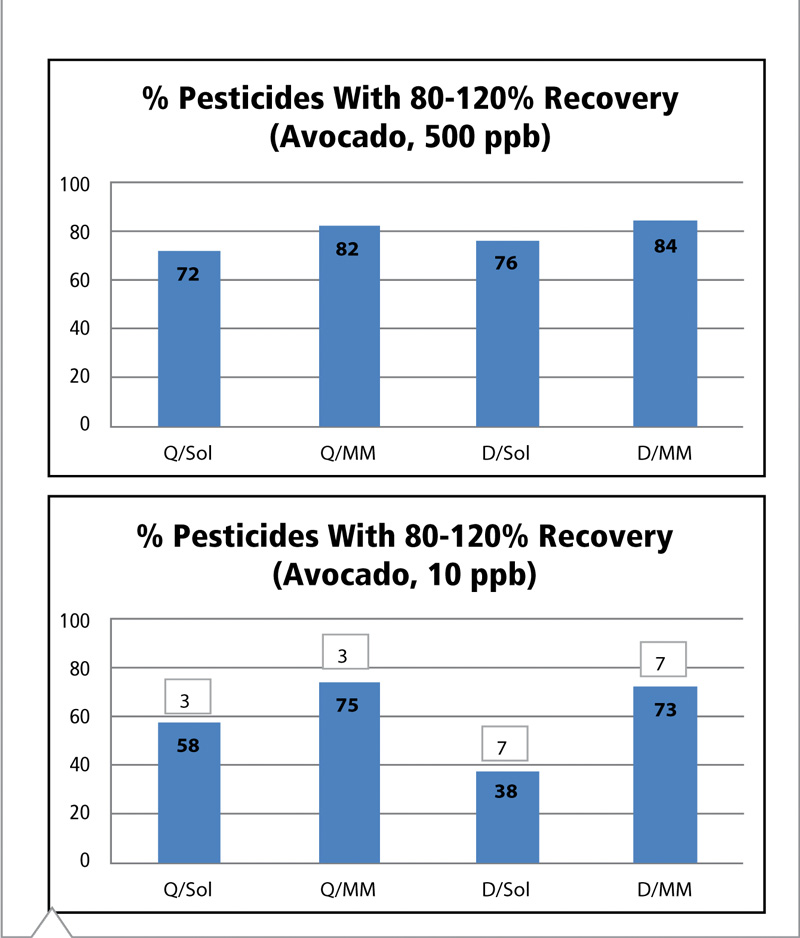
Figura 10: Comparación del porcentaje de plaguicidas con recuperaciones aceptables (80-120%) mediante estrategia de preparación/calibración de muestras a niveles de fortificación de 500 y 10 ppb en palta. (Véase Tabla VI para consultar abreviaturas).
La palta posee un alto contenido graso y alrededor de un 15% de contenido lipídico. Puede resultar una matriz compleja para analizar, dado que algunos lípidos se coextraen en acetonitrilo junto con los plaguicidas. A 500 ppb, las cuatro estrategias distintas produjeron resultados similares, pero se observaron mejorías cuando se utilizó la calibración de matriz pareada (Figura 10). Para el menor nivel de fortificación, el beneficio de utilizar la calibración de matriz pareada es incluso mayor. Cuando se utiliza la calibración con disolvente, el abordaje QuEChERS generó más compuestos con valores de recuperación aceptables que el método de dilución, probablemente porque el procedimiento QuEChERS empleó sorbente C18 para remover parte del material lipídico coextraído. El método de dilución resultó inferior, probablemente debido a que la dilución no fue capaz de minimizar los problemas de ionización causados por los lípidos coextraídos. Los datos del efecto matriz avalan esta situación, dado que muestran que el efecto matriz fue más pronunciado al final del análisis cromatográficos donde se espera que los lípidos se eluyan (Figura 3).
El efecto matriz es significativo para el esquema de dilución/calibración con disolvente, pero el uso de la calibración de matriz pareada lo compensó muy bien y produjo mejores valores de recuperación. Los datos del método QuEChERS/calibración de matriz pareada son casi idénticos a aquellos arrojados por el método de dilución/calibración de matriz pareada, pero con menor pérdida de compuestos debido a la sensibilidad del nivel de 10 ppb. En los casos de los compuestos que no se detectan, los tres plaguicidas no detectados que utilizaron métodos QuEChERS son los mismos y se incluyen en los siete que no se detectaron para los métodos de dilución. Esto es común para plaguicidas no detectados e indica que las pérdidas se deben a la limitación de la sensibilidad y no se asocian a pérdidas por la limpieza de la muestra con QuEChERS. Sin embargo, en algunas ocasiones, el material (arroz) o la limpieza (GCB) generan baja recuperación, y estos plaguicidas son difíciles de detectar a 10 ppb.
Se sabe que resulta complejo emplear las técnicas basadas en LC-MS con frutas cítricas, pero de todos modos comparamos los métodos de preparación y calibración de muestras. A 500 ppb, los valores de recuperación son bajos en todos los métodos (Figura 11). Se observa un aumento del 20%, o alrededor de 20 compuestos, para el método QuEChERS cuando se utiliza la calibración de matriz pareada. Esto demuestra la influencia que puede tener la calibración de matriz pareada sobre la calidad de los datos. El método de dilución muestra resultados similares entre calibración con disolvente y matriz pareada. A 10 ppb, es evidente que se trata de una matriz compleja para el análisis de trazas por los valores de 21 y 39% producidos con calibración de disolvente. También es evidente que el uso de una curva de matriz pareada puede compensar el efecto matriz para muchos plaguicidas. Utilizar una curva de matriz pareada tanto para el método de preparación de muestras QuEChERS como para el método de dilución aumenta significativamente el número de plaguicidas que muestran una buena recuperación, en alrededor de 20 y 40 compuestos respectivamente. Es importante advertir que los métodos de dilución perdieron detectabilidad para 8 compuestos.
La harina de arroz integral posee bajo contenido de agua y altos niveles de carbohidratos. Los productos secos, como los granos, presentan un desafío analítico, dado que producen extractos con elevada concentración de coextractos. La estrategia de dilución/calibración de disolvente presenta muchos inconvenientes y no resulta un método viable para este tipo de matriz (Figura 12). La calibración de matriz pareada es significativamente ventajosa cuando se la utiliza con el método de dilución a ambos niveles de concentración. Para el método QuEChERS, tanto con calibración de disolvente como calibración de matriz pareada, los datos muestran el beneficio de remover algunos coextractos con limpieza dSPE. El proceso de limpieza empleado aquí incluyó PSA, que puede remover ácidos grasos. Esto resulta útil para granos que contienen grandes cantidades de ácidos grasos en el extracto. Debido a los bajos valores de 10 ppb para todos los esquemas, es probable que se necesite la combinación de una rigurosa limpieza, alta dilución, y calibración de matriz pareada para arrojar resultados aceptables.
Se desprenden varias ideas a partir de la evaluación de distintos abordajes de preparación y calibración de muestras. Todas las estrategias enfrentan inconvenientes para producir valores de recuperación aceptables a medida que los materiales se complejizan y se vuelven susceptibles al efecto matriz cada vez más fuerte. Esto podría requerir un ajuste al diseño experimental para alcanzar resultados aceptables. Para todos los alimentos examinados en este trabajo, se debe poner en la balanza el tiempo dedicado a la limpieza de la muestra y la pérdida de detectabilidad de algunos analitos debido a las limitaciones de sensibilidad. Esto se puede minimizar mediante factores más altos de dilución cuando la instrumentación así lo permita, pero para algunos alimentos puede ser necesario remover los coextractos. La calibración de matriz pareada es una estrategia potente para asegurar la calidad de los datos.
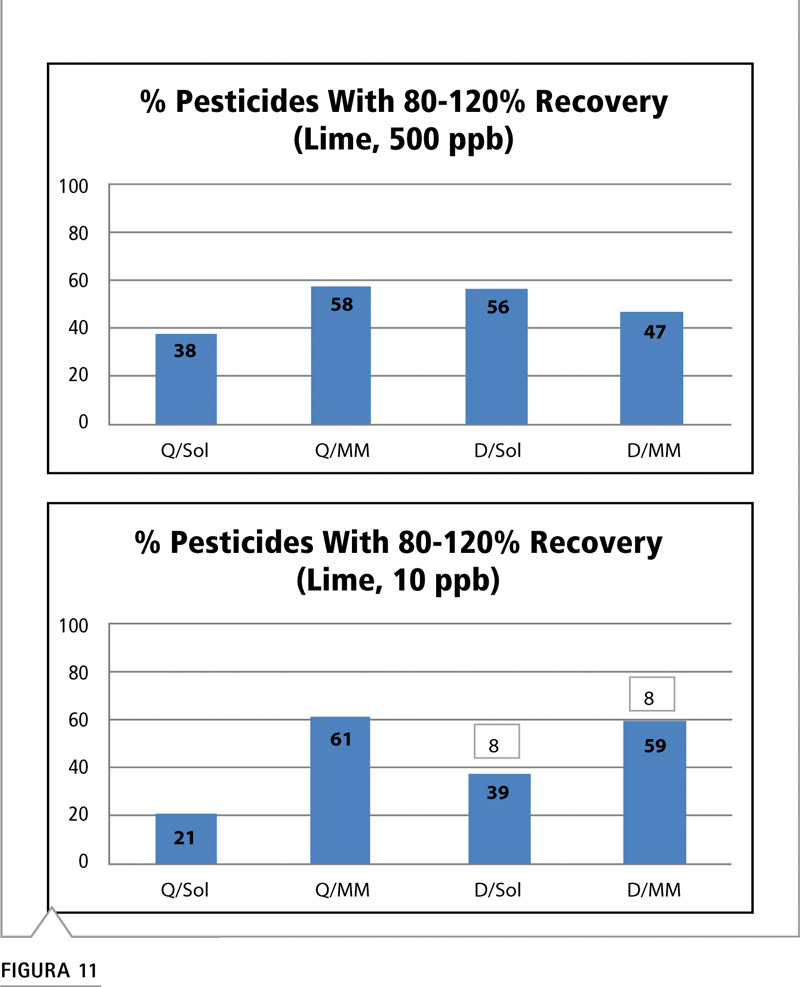
Figura 11: Comparación del porcentaje de plaguicidas con recuperaciones aceptables (80-120%) mediante estrategia de preparación/calibración de muestras a niveles de fortificación de 500 y 10 ppb en lima. (Véase Tabla VI para consultar abreviaturas).
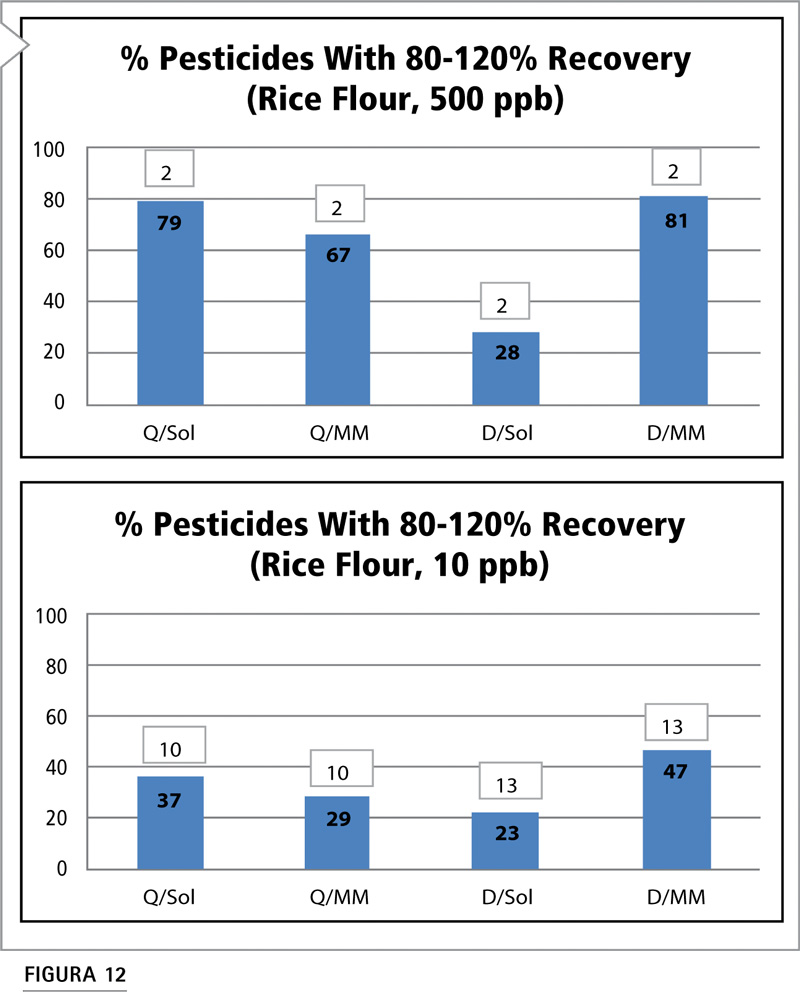
Figura 12: Comparación del porcentaje de plaguicidas con recuperaciones aceptables (80-120%) mediante estrategia de preparación/calibración de muestras a niveles de fortificación de 500 y 10 ppb en harina de arroz integral. (Véase Tabla VI para consultar abreviaturas).
Conclusiones
Es importante considerar el efecto matriz durante el desarrollo del método de cualquier abordaje de residuo de plaguicidas, debido a su fuerte impacto sobre la calidad de los datos. Las estrategias de preparación de muestras deben diseñarse y probarse para minimizar el efecto matriz y asegurar la buena calidad de los datos. Los estudios del efecto matriz pueden ser útiles para determinar regiones de un cromatograma que se ven seriamente afectadas por dicho efecto, y, por lo tanto, arrojan información sobre la naturaleza de los compuestos de interferencia. Esta información puede generar cambios en las condiciones cromatográficas para minimizar los analitos que eluyen con compuestos de interferencia, o identificar el mejor método de limpieza de muestras. En general, el efecto matriz severo requiere más preparación de la muestra o factores de dilución más elevados.
La elección de los métodos de preparación y calibración de muestras depende en gran medida del material de referencia. Algunos materiales más sencillos con alto contenido de agua probablemente arrojen mejores resultados con los métodos QuEChERS o dilución, donde el uso de la calibración de matriz pareada puede no ser necesaria. Los materiales que producen fuertes efectos matriz, como los granos, requieren la preparación de la muestra o mayores factores de dilución, como también calibración de matriz pareada. Los alimentos que poseen alto contenido graso pueden resultar complejos, y requerirán la limpieza de la muestra, altas diluciones y probablemente calibración de matriz pareada. Para los materiales más difíciles, como granos secos, los métodos exitosos probablemente involucren una sustancial limpieza de la muestra junto con dilución y calibración de matriz pareada.
La calibración de matriz pareada resultó ser el método más efectivo para mejorar los resultados, independientemente de la técnica de preparación de las muestras. La preparación de la muestra es costosa y requiere tiempo, y a veces puede provocar la remoción de analitos durante el procesamiento, pero en algunos casos resulta necesaria para estos tipos de materiales. Los métodos de dilución no requieren tanto tiempo y no resultan tan costosos para el procesamiento de las muestras. Sin embargo, se necesitan altas diluciones en muchos casos, lo que hará que algunos analitos caigan por debajo de los límites de detección y requieran el uso de instrumentos más nuevos y costosos. Estas son algunas de las variables y concesiones que se deben considerar al desarrollar esquemas para pruebas de residuos de plaguicidas.
Referencias