Mejorando la productividad en el aislamiento de compuestos Bioactivos naturales

L os productos naturales son una fuente importante para la producción de nuevos fármacos debido a su gran diversidad química, especificidad bioquímica y propiedades moleculares con utilidad farmacológica(1-4). Una gran proporción de los medicamentos que actualmente existen en el mercado son derivados directos de compuestos naturales, o inspirados en productos naturales. Adicionalmente, los productos naturales son también utilizados en suplementos dietarios, nutracéuticos y medicinas alternativas, y como ingredientes activos en cosméticos(5).
El aislamiento y purificación de compuestos bioactivos juega un rol importante en la investigación de productos naturales. Los procesos comúnmente utilizados involucran la extracción de los compuestos de interés de matrices celulares, pre-purificación por variadas técnicas cromatográficas incluyendo “cromatografía flash” (FC), cromatografía liquida de baja presión (LPLC) y media presión (MPLC), seguida por cromatografía preparativa de alta presión (HPLC) (6). Sin embargo, estos procesos no están libres de desafíos.
Por otra parte, los métodos convencionales de extracción de productos naturales pueden incluir extracción Soxhlet, maceración, percolación y sonicación. Estos métodos son frecuentemente laboriosos, consumen grandes cantidades de solventes y pueden llevar a la degradación de compuestos termolábiles. Por su parte, la cromatografía preparativa está ampliamente dominada por la cromatografía en fase reversa (RPLC), donde la separación se basa en la diferencia de polaridad de los analitos. Sin embargo, RPLC no necesariamente garantiza una adecuada resolución de todos los analitos, especialmente aquellos análogos estructurales e isómeros de polaridad similar como frecuentemente se encuentran en los productos naturales.
Es así como muchos científicos perciben el paso de purificación como un paso limitante, en relación al tiempo consumido, y el mayor cuello de botella para el descubrimiento de drogas naturales, el desarrollo de nutracéuticos y de productos cosméticos novedosos(7).
A este respecto, las técnicas basadas en fluidos supercríticos (SF), incluyendo la extracción por fluidos supercríticos (SFE) y la cromatografía de fluidos supercríticos (SFC) pueden ofrecer alternativas viables para el aislamiento de productos naturales debido a propiedades únicas del CO2 supercrítico: alta difusividad, baja viscosidad y excelente poder de solvatación. SFE ha sido aplicado con amplio éxito a la extracción de diversos compuestos bioactivos de plantas medicinales incluyendo esteroides, terpenos, alcaloides y compuestos fenólicos6. Por su parte, la cromatografía preparativa de fluidos supercríticos ha sido ampliamente adoptada por la industria farmacéutica para la purificación de ingredientes activos (API), aunque su aplicación para el aislamiento de productos naturales no ha crecido mucho(8).
En esta nota de aplicación describimos un trabajo sistemático para mejorar holísticamente la productividad en el aislamiento de un derivado natural de un terpeno con propiedades bioactivas anticancerígenas demostradas sobre una muestra de una planta. El proceso incluye una extracción por SFE seguida por tres rutas alternativas para la purificación en dos pasos, incluyendo MPLC+HPLC, MPLC+SFC y SFC+SFC. El objetivo es la comparación de la productividad general y el consumo de solvente para cada ruta de purificación.
EXPERIMENTAL
Materiales y reactivos
Metanol e isopropanol (IPA) grado HPLC Thermo Fisher Scientific (Fair Lawn, NJ, USA). Etanol desnaturalizado grado reactivo Sigma (St. Louis, MO, USA).
El material molido de planta se usó tal como se recibió.
Preparación de la muestra
Extracción con solvente
Se colocaron 0.3 g de planta molida y 6 mL de metanol en un tubo de ensayos de 10 mL. Se sonicó durante 1 hora a 40 °C, se centrifugo la suspensión durante 5 minutos y el sobrenadante se transfirió a un vial limpio para su análisis.
Extracción por Fluido Supercrítico
El experimento de extracción se hizo con sistema Waters® MV-10 ASFE® controlado por software ChromScope Sample Prep. Se pesaron 3 g de planta molida en un recipiente de extracción de 5 mL y se extrajo durante 60 minutos con CO2 a 8 mL/min. El efluente se llevó a un vaso de recolección de 100 mL con un flujo auxiliar de 1 mL/min de metanol -isopropanol – hexano (1:1:1).
Cromatografía
Los experimentos analíticos LC-MS se ejecutaron usando un sistema Waters ACQUITY UPLC Clase H con detector de simple cuadrupolo SQD 2 y un Sistema Waters LC Auto-Purification. Los experimentos analíticos de fluidos supercríticos se ejecutaron usando un sistema Waters ACQUITY UPC2-MS. Todos los sistemas se controlaron con el software MassLynx.
Para los experimentos preparativos dirigidos por MS-SFC se usó usando un sistema Waters Prep 100q SFC MS controlado por software FractionLynx en MassLynx. Para los experimentos preparativos dirigidos por UV se utilizó un sistema Waters SFC 80 Preparativo controlado por el software ChromScope. Los parámetros experimentales detallados se reportan en las tablas 1-3.
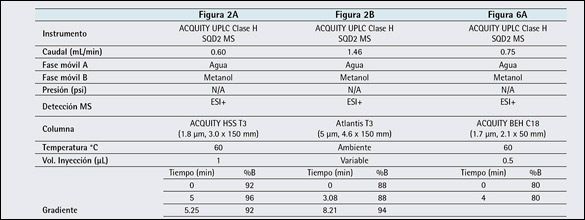
Tabla 1: Parámetros experimentales para LC analítica.
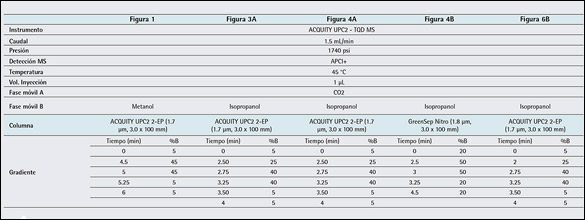
Tabla 2: Parámetros experimentales para UPC2.
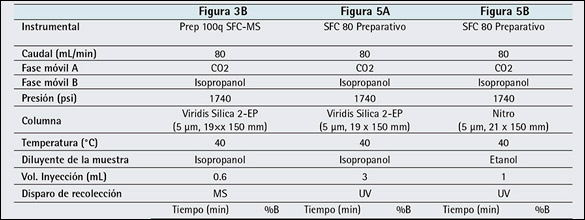
Tabla 3: Parámetros experimentales para cromatografía preparativa.
RESULTADOS Y DISCUSION
Extracción de compuestos de interés usando SFE
Los procesos de extracción solido-liquido tal como la extracción por solventes y SFE están basados en la solubilidad. El proceso comprende la difusión del solvente de extracción dentro de la matriz para disolver el analito buscado en el solvente y el transporte del analito extraído a un recipiente de recolección. Los solventes de extracción polares, por ejemplo, alcoholes, frecuentemente producen extractos que contienen mezclas de compuestos polares y no polares. Por el contrario, el CO2 supercrítico es un solvente altamente lipofilico, y como resultado solo los compuestos no polares son típicamente extraídos. En este estudio, el compuesto buscado es un terpeno derivado con una masa nominal de 390.28 Da y un logaritmo decimal del coeficiente de reparto (LogP) de 3.0. El bajo peso molecular y la relativamente baja polaridad hacen que sea un candidato ideal para la extracción por SFE.
La figura 1 muestra los Cromatogramas UPC2-MS de dos extractos obtenidos por SFE (figura 1 A) y extracción con metanol (figura 1B), usando una columna BEH 2-EP.
Como 2-EP (2-etilpiridina) es una fase estacionaria polar, el orden de elución de los compuestos generalmente se relaciona con sus polaridades.
Como ambos extractos contienen similar cantidad del compuesto buscado, es evidente que SFE produjo un extracto mucho más simple en comparación con el extracto metanólico. Para el extracto SFE, los picos inmediatamente posteriores al compuesto buscado (1.20–1.75 min, rectángulo azul) son mucho más pequeños que en el extracto metanólico, y los picos entre 1.75 y 3.50 min (rectángulo rojo) solo están presentes en el extracto metanólico. En general el extracto SFE es mucho más simple y consiste en una mezcla de unos pocos compuestos polares. SFE resulta entonces más apropiado para la purificación del compuesto buscado porque aumenta la capacidad de carga en cromatografía preparativa y necesita menor concentración de solvente orgánico (fase móvil B) para eluir completamente al componente del extracto. Como resultado, el tiempo total de corrida y consumo de solvente son menores, aumentando la productividad. Los experimentos de SFC preparativa se describen más adelante.
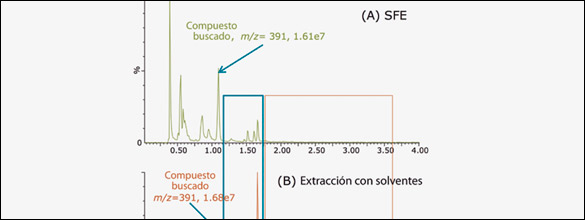
Figura 1: Cromatogramas UPC2-MS de mezclas obtenidas por (A) SFE y (B) extraccion metanolica usando una columna ACQUITY UPC2 2-EP.
Purificación Convencional: MPLC + HPLC
La aproximación más común para el aislamiento de productos naturales consiste en MPLC seguido por HPLC. En este caso, el extracto SFE proviene de un paso previo de purificación por MPLC (resultados no mostrados), obteniendo un compuesto de pureza mayor de 97% (referido en adelante como fracción MPLC). La impureza principal remanente tiene una masa nominal de 360.27 Da, y es el resultado de la desmetoxilación del compuesto buscado. La similitud estructural entre compuesto e impureza es un desafío para la purificación por RPLC. La figura 2 A muestra los cromatogramas UPLC-MS y UV de la fracción MPLC. Se consigue resolución a línea de base entre compuesto e impureza usando una columna UPLC de 3.0 x 150 mm, donde la impureza se presenta como un aducto de sodio con m/z = 383. La cercanía de elución de los dos picos, sin embargo, deteriora severamente la capacidad de carga para la purificación RPLC.
La figura 2B muestra un estudio de carga de la fracción MPLC en una columna analítica (5 μm, 4.6 x 150 mm). La resolución a línea de base solo se mantiene inyectando 10 mL, pero con un volumen de inyección de 80 mL, la impureza coeluye con superposición total con el pico del compuesto buscado. Además de la resolución limitada, el orden de elución tampoco contribuye con la productividad porque en RPLC, la impureza eluye antes del compuesto buscado. Cuando compuesto e impureza se separan parcialmente, como en la figura 2B para 40 µL de inyección, aún es posible obtener el compuesto puro eliminando el frente del pico, sector donde coeluye la impureza. Esta práctica no es en general recomendable en cromatografía preparativa porque el frente del pico contiene una porción considerable del compuesto que intentamos purificar.
En base al estudio de carga en la columna analítica, la máxima carga en una columna semi-preparativa de 19 x 150 mm se proyectó a 170 mL, sin compromiso de pureza. A unos 20 mg/mL, esto significa unos 3.4 mg/inyección.
Incremento de la capacidad de carga utilizando la ortogonalidad entre MPLC y SFC
SFC se considera una técnica cromatográfica de fase normal cuando se utiliza una fase estacionaria tal como 2-EP. Entonces, el orden de elución se revierte respecto de RPLC con columna de C18. La figura 3A muestra cromatogramas UPC2-MS y UV para la fracción MPLC usando una columna BEH 2-EP.
Comparado con la figura 2A, el método UPC2 provee mejor resolución, pero también invierte el orden de elución entre compuesto e impureza. El Cromatograma se escala entonces a columna semi-preparativa de 19 x 100 mm resultando el cromatograma de la figura 3B. La resolución se mantuvo con 600-μL de inyección a 20 mg/mL. El tiempo total de corrida con SFC fue de 8 minutos en comparación a los 20 minutos usando RPLC. El cambio de prep RPLC por prep SFC mejoró la productividad unas 9 veces: 2.5 veces el tiempo de corrida y 3.5 veces el incremento de la capacidad de carga.
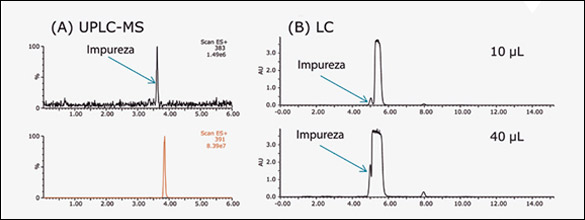
Figura 2: (A) Cromatogramas UPLC-MS y UV de la fracción MPLC fracción a 1 mg/mL; y (B) Cromatogramas LC/UV de la fracción MPLC a 20 mg/mL.
Incremento de la productividad de purificación usando diferente química de columnas
A pesar del aumento de productividad mostrado por la figura 3, el proceso total todavía muestra un alto consumo de solvente, fundamentalmente debido al paso inicial por MPLC. El compuesto buscado tiene polaridad relativamente baja, y requiere un porcentaje alto de solvente orgánico para su elución. En SFC, el CO2 es el componente primario de la fase móvil y es lipofílico, reduciendo el uso de solvente orgánico (fase móvil B). Más aun, la muestra se extrae con CO2, esencialmente compatible con SFC.
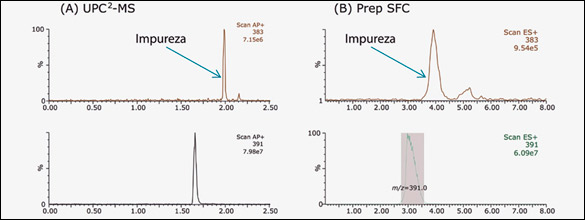
Figura 3: (A) Cromatogramas UPC2-MS y UV de la fracción MPLC a 1 mg/mL; y (B) Cromatogramas prep SFC-MS y UV de la fracción MPLC a 20 mg/mL.
Existe un amplio rango de química de columnas disponibles para SFC, con variados mecanismos de reacción que incluyen interacciones polares, hidrofóbicas, π-π y reconocimiento estérico. Con una selección apropiada de la columna, SFC puede proporcionar la selectividad ortogonal necesaria para la complejidad intrínseca de productos de origen natural. La figura 4 muestra cromatogramas UPC2-MS y UV de extractos SFE usando columnas BEH 2-EP (Figura 4A) y nitro (Figura 4B). Mientras las columnas 2-EP típicamente proporcionan interacciones polares entre analitos y fase estacionaria, las columnas nitro retienen y separan analitos basadas en interacciones π-π. Estas combinaciones proveen mecanismos complementarios de separación. La figura 4 muestra la elución de un compuesto con m/z = 391 con una columna 2-EP y su separación de la impureza de m/z = 361, aunque menor separación de otra impureza más retenida con m/z = 239. En contraste, en una columna nitro, la impureza de m/z = 239 eluye antes y es bien separada del compuesto buscado, pero la impureza de m/z = 361 coeluye con el compuesto buscado.
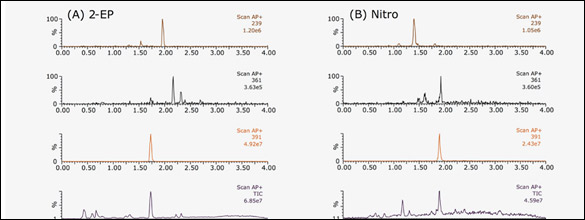
Figura 4: Cromatogramas UPC2-MS y UV del extracto SFE usando (A) 2-EP; y (B) con columna nitro.
En consecuencia, se implementó una estrategia de purificación de dos pasos: columna 2-EP para remover la impureza principal con m/z = 361 seguida de columna nitro para remover impurezas adicionales tales como aquella de m/z = 239. El resultado se muestra en la figura 5. El rendimiento global, definido como la relación del peso del material purificado respecto del peso del extracto a purificar fue similar al de otras aproximaciones, MPLC+HPLC y MPLC+SFC.
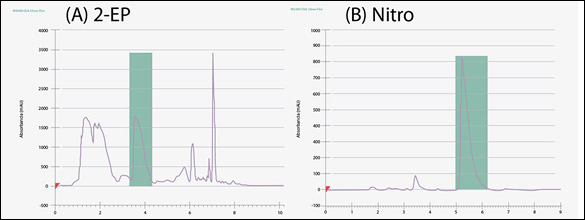
Figura 5: (A) Cromatograma SFC/UV del extracto SFE a 133 mg/mL usando una columna Viridis 2-EP; y (B) Cromatograma SFC/UV de la fracción colectada del paso Viridis 2-EP con una columna nitro.
Las alícuotas del producto final purificado fueron analizadas por UPC2-MS y por UPLC-MS y los cromatogramas resultantes se muestran en la figura 6. Ambas impurezas se removieron exitosamente, y los resultados muestran un producto de pureza mayor de 99% por UV. El resultado usando purificación por SFC fue menor volumen de fracción comparado con MPLC y HPLC, que pudieron secarse en condiciones suaves minimizando la perdida de material por degradación térmica durante el proceso. En comparación con LC, SFC mostro una recuperación más fácil y rápida.
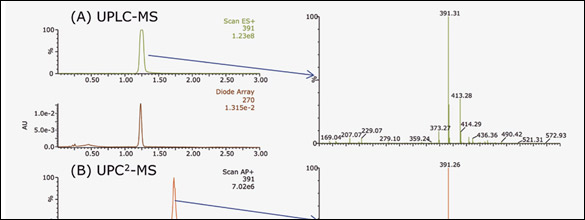
Figura 6: Análisis de pureza del producto final por (A) UPLC-MS y (B) UPC2-MS.
CONCLUSIONES
Puede comprobarse que el empleo holístico de SFE y Prep SFC pueden mejorar la productividad en el aislamiento de compuestos bioactivos de baja polaridad a partir de un extracto de un producto natural complejo. SFE simplifica el tratamiento de muestras complejas previo al análisis y purificación, mejorando la capacidad de carga y reduciendo el uso de solventes necesarios para la cromatografía. El extracto SFE se complementa bien con el análisis y purificación por SFC.
En la ruta de purificación MPLC+HPLC, el compuesto derivado desmetoxilado forma un par critico que limita la capacidad de carga en HPLC, y por tanto la productividad de la preparación. El mismo par critico fue separado convenientemente en una columna 2-EP usando SFC. El orden de elución se invierte, permitiendo una mayor capacidad de carga.
Globalmente, la ruta MPLC+SFC permite incrementar 9 veces la productividad. Sin embargo, ambas rutas precisan de un alto consumo de solventes por el paso de MPLC. Finalmente, se ha desarrollado un proceso de purificación SFC+SFC que brinda una selectividad ortogonal entre las diferentes química de columnas disponibles, y la ruta SFC+SFC no solo condujo a un aumento de 16 veces la productividad, sino también una reducción en el consumo de solventes del 90%.

Adicionalmente, SFE+SFC brindan una recuperación simple de los extractos bajo condiciones suaves que minimizan una perdida potencial debida a degradación térmica asociada al proceso de secado.
Las técnicas basadas en fluidos supercríticos SFE y SFC aumentan la variedad de herramientas para la investigación de productos naturales, ofreciendo selectividad única tanto para la extracción como para el análisis, y potencian a los laboratorios y empresas farmacéuticas de medicina tradicional, nutracéuticos, de suplementos dietarios y cosméticos para la producción y purificación más económica y eficiente de productos naturales.

Referencias
1. Harvey AL, Strategies for discovering drugs from previously unexplored natural products. Drug Discovery Today, 2000; 5 (7):294–300.
2. Harvey AL, Natural products in drug discovery. Drug Discovery Today, 2008; 13 (19/20):894–901.
3. Li JWH, Vederas JC, Drug Discovery and natural products: end of an era or endless frontier? Science, 2009; 325 (10):161–165.
4. Harvey AL. Natural Products as a screening source, Curr. Opin. Chem. Biol., 2007, 11: 480–484.
5. Sarker SD, Latif Z, Gary AI, Natural product isolation: an overview, Natural Product Isolation, 2nd ed. Eds. Sarker SD, Latif Z, Gary AI, Humana Press Inc. Totowa, NJ. 2006, P1–25.
6. Sticher O, Natural product isolation, Nat. Prod. Rep., 2008, 25, 517–554.
7. Koehn FE, Carter G, The evolving role of natural products in drug discovery, Nat. Rev. Drug Discov. 2005, 4: 206–220.
8. Ramirez P, Garcia-Risco MR, Santoyo S, Senorans FJ, Ibanez E, Reglero G, J. Pharmaceu. Biomed. 2006, 41:1606–1613.
Mayor información:
D´Amico Sistemas S.A.
Tel./Fax: 54-11 4306-0920 (líneas rotativas)
ventas@damicosistemas.com
www.damicosistemas.com